在0.25 mol Na2SO4中,含有的氧原子个数约为
| A.1 | B.0.25 |
| C.6.02×1023 | D.3.01×1023 |
牙釉质的主要成分羟基磷灰石[Ca10(PO4)6(OH)2]在水中能极少溶解Ca10(PO4)6(OH)2(s)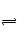 10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]="2.35" ×10-59, Ksp[Ca10(PO4)6F2]=7.1× 10-61,Ksp[CaCO3]="5" ×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是()
10Ca2+(aq)+6PO43-(aq)+2OH-(aq),已知25℃时Ksp[Ca10(PO4)6(OH)2]="2.35" ×10-59, Ksp[Ca10(PO4)6F2]=7.1× 10-61,Ksp[CaCO3]="5" ×10-9,Ksp[CaF2]=4×10-11,下列说法不正确是()
| A.口腔内残留食物会发酵使口腔呈酸性,所以饭后、睡前应该要漱口 |
| B.饮用水中氟元素含量较低的地区使用含氟牙膏可有效防止龋齿 |
| C.25℃时饱和CaCO3溶液和饱和CaF2溶液相比,后者c(Ca2+)较大 |
| D.25℃时,在CaCO3悬浊液中加入NaF溶液后,CaCO3不可能转化为CaF2 |
有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断不正确的是()
| A.肯定没有NH4+、HCO3-、MnO4- | B.可能有K+、Cl- |
C. 肯定有Al3+、Mg2+、SO42- 肯定有Al3+、Mg2+、SO42- |
D.可能有K+、Cl-、HCO3- |
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是()
| A.若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝 |
| C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D.若A为浓硫酸,B为炭,C中盛有苯酚钠溶液,则C中出现白色混浊 |
已知常温下:PH(NaHCO3)>7>PH(NaHSO3)。则在NaHCO3或NaHSO3溶液中,有关微粒的物质的量浓度表示式一定正确的是(X表示S或C)()
A.C(Na+)>C(HXO3-)>C(OH-)>C(H2XO3)>C(XO32-)
B.C(Na+)+C(H+)=C(OH-)+C(XO32-)+C(HXO3-)
C.C(H2XO3)+C(HXO3-)+C(XO32-)=C(Na+)
D.C(OH-)=C(H+)+C(HXO3-)+C(H2XO3)
取等体积、等浓度的两份NaOH溶液,把其中一份A放在空气中一段时间,另一份B密封保存;用已知浓度的硫酸溶液中和上述两份溶液,若所消耗的硫酸溶液体积分别为VA和VB,则下列说法正确的是()
| A.若用甲基橙作指示剂,VA>VB | B.若用甲基橙作指示剂,VA<VB |
| C.若用酚酞作指示剂,VA>VB | D.若用酚酞作指示剂,VA<VB |