现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。
请回答下列问题:
(1)元素B在周期表中的位置是___________,元素D的原子结构示意图为___________。
(2)A、D、E 3种元素形成一种离子化合物,其水溶液呈碱性,试用离子方程式表示该溶液中存在的所有平衡 。
(3)A2C比A2E沸点高的原因是 。
(4)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为 ,负极的电极反应式为 ;
(5)该电池在放电过程中,电解质溶液的pH将_________(填“增大”、“减小”或“不变”)。
化合物B2A4 和B2C4 的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol B2A4与B2C4完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为 。
某无色溶液,其中可能存在的离子有:Na+、Ag+、Ba2+、Fe3+、Al3+、AlO2-、S2-、SO32-、CO32-、SO42-,现取该溶液进行实验,实验结果如下: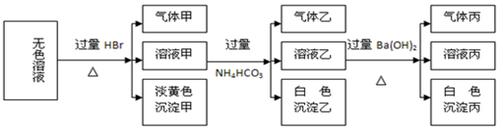
试回答下列问题:
(1)生成沉淀甲的离子方程式为:。
(2)由溶液甲生成沉淀乙的离子方程式为。
(3)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表(表中每一行对应正确即可得分)
| 步骤 |
实验目的 |
试剂 |
现象 |
| 1 |
|||
| 2 |
|||
| 3 |
检验CO2 |
澄清石灰水 |
溶液变浑浊 |
(4)综上所述,该溶液肯定存在的离子有:。
(5)针对溶液中可能存在的离子,用实验证明是否存在的方法是。
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下: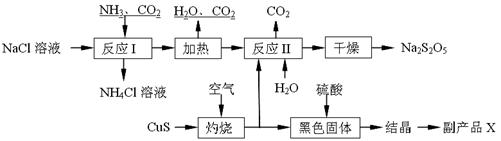
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:。
(2)“灼烧”时发生反应的化学方程式:。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:。
(4)副产品X的化学式是:;可循环利用的物质是:__________________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为。
下列关系中,A是一种正盐,D的分子量比C的分子量大16,E是酸;当X无论是强碱还是强酸时都有如下转化关系: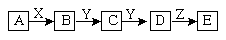
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强酸时,A、B、C、D、E均同时含有另一种元素。回答下列问题:(用化学式填写)
(1)A是_____________,Y是______________,Z是____________。
(2)当X是强碱时,写出B与Y反应的化学方程式:___________________________。
(3)当X是强酸时,写出C与Y反应的化学方程式:___________________________。
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO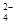 ,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
,常用作脱氯剂,该反应的离子方程式为______________________________________________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式:_________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式:______________________、_________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式:____________。
(16分) 物质的量是高中化学中常用的物理量,请完成以下有关其内容的计算:
(1)标准状况下,含有相同氧原子数的CO与CO2的体积之比为______。
(2)等温等压下,等体积的O2和O3所含分子个数比为________ ,原子个数比为________ ,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g某气中含有的分子数为b,则c g某气在标准状况下的体积约是________。 (用含NA的式子表示).
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为_______ mL.
(5)100 mL 某Al2(SO4)3溶液中,n(Al3+)=0.20 mol,则其中c(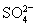 )= ______mol/L。
)= ______mol/L。
(6)某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数5.6%,300mL该溶液中Cl-的物质的量等于______ .