用等质量的金属钠进行下列实验,生成H2最多的是
| A.将钠块放入足量水中 |
| B.将钠块放入足量稀HCl中 |
| C.用有小洞的铝箔包住钠块,放入足量水中 |
| D.用有小洞的金箔包住钠块,放入足量水中 |
下列说法不正确的是()
| A.一个反应能否自发进行取决于该反应放热还是吸热 |
| B.同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| C.焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| D.一个反应能否自发进行,与焓变和熵变的共同影响有关 |
下图所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色。下列说法正确的是()
| A.NaCl溶液浓度不变 | B.X是负极,Y是正极 |
| C.CuSO4溶液浓度变小 | D.X是正极,Y是负极 |

对于反应A2+3B2 2C来说,以下化学表示的反应速率最快的是()
2C来说,以下化学表示的反应速率最快的是()
A.v(B2)="0.8" mol·L-1·s-1 B. v(B2)="0.42" mol·L-1·s-1
C.v(C)="0.6" mol·L-1·s-1 D. v(A2)="0.4" mol·L-1·s-1
温度不变,在恒容的容器中进行下列反应:N2O4(g)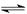 2NO2(g),若N2O4的浓度由0.1 mol· L-1降到0.07 mol· L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需反应的时间()
2NO2(g),若N2O4的浓度由0.1 mol· L-1降到0.07 mol· L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需反应的时间()
| A.大于10 s | B.等于10 s | C.等于5 s | D.小于10 s |
我国拥有完全自主产权的氢氧燃料电池车在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是()
| A.正极反应式为:O2+2H2O+4e- ="=" 4OH- |
| B.用该电池电解CuCl2溶液,产生2.24LCl2(标况)时,有0.1mol电子转移 |
| C.该燃料电池的总反应方程式为:2H2+O2==2H2O |
| D.工作一段时间后,电解液中的KOH的物质的量不变 |