学习小组探究中和反应。
I 取20mL l mol/L的KOH溶液,滴加酚酞试液
II 向I中溶液内逐滴加入某浓度的H2SO4溶液,至10mL时,刚好完全反应
III 另取20mL l mol/L的KOH溶液,加入与II中同浓度的H2SO4溶液20mL
Ⅳ 蒸干III中所得溶液,得到白色固体甲
V 将Ⅳ中所得固体甲完全溶于水,加入0.1mol/L Ba(OH)2溶液至沉淀最多
(1)I中实验现象及结论是 。
(2)II中反应的离子方程式是 ,所用H2SO4溶液的物质的量浓度是 。
(3)III中所得溶液里各阳离子的物质的量浓度分别是 。
(4)V中得到最大沉淀量时反应的离子方程式是 ,所加入的Ba(OH)2溶液的体积是 。
现有①BaCl2②金刚石③金属铜④KOH ⑤干冰⑥纯硫酸⑦二氧化硅⑧白磷⑨K2O⑩NH4Cl十种物质,按下列要求回答(填序号):
⑴熔化时需要破坏共价键的是;⑵属于分子晶体的是;
⑶固体不导电,常压下熔化时能导电的是;⑷④的电子式。
下列各物质:①O2、O3②H2、D2、T2③12C、14C
④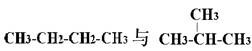 ⑤
⑤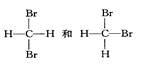
互为同分异构体的是(填序号,下同);互为同位素的是
互为同素异形体的是;是同一种分子的是
某有机物A(只含C、H、O三种元素)是一种重要化工生产的中间体。已知:
①A的蒸气密度是相同状况下氢气密度的83倍,分子中碳原子总数是氧原子总数的3倍。
②A属于芳香族化合物,其苯环上只有一个取代基,且取代基碳链上无支链;
③A可与NaHCO3溶液作用,产生无色气泡;
④A在一定条件下可与乙酸发生酯化反应;
⑤A存在如下转化关系:
试根据以上信息回答问题:
(1)A的分子式__________________;A中含氧官能团的名称__________________。
(2)D的结构简式为__________________。
(3)写出A→C和A→B的化学反应方程式(注明反应条件),并注明反应类型:
A→C:_______________________ _,反应类型:__________________;
_,反应类型:__________________;
A→B:________________________,反应类型:__________________。
(4)符合下列三个条件的A的同分异构体的数目共有__________________个。
①苯环上只有两个邻位取代基
②能与三氯化铁溶液发生显色反应
③一定条件下可以水解生成两种物质
写出其中任意一个同分异构体的结构简式______________________________。
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
⑴ 写出QT2+的电子式______、基态Z原子的核外电子排布式______。
⑵ Q的简单氢化物极易溶于T的简单氢化物,其主要原因有______等两种。
⑶ 化合物甲由T、X两元素组成,其晶胞如图1,甲的化学式为______。
⑷化合物乙的晶胞如图2,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为______。
②乙的晶体中E、Q两种元素原子的杂化方式均为______。
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)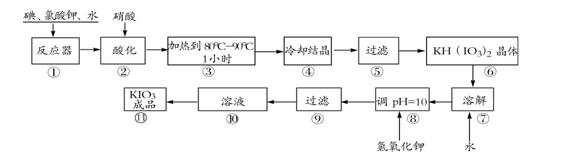
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式: _______________。
若有1 mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是__________。
| 温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。