把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中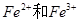 的物质的量浓度之比为1:2,则已反应的
的物质的量浓度之比为1:2,则已反应的 和未反应的
和未反应的 的物质的量之比为
的物质的量之比为
| A.1:1 | B.1::2 | C.1:3 | D.2:3 |
在N2+3H2 2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是()
2NH3反应中,自反应开始至2 s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是()
| A.0.3 mol·L-1·s-1 | B.0.4 mol·L-1·s-1 |
| C.0.6 mol·L-1·s-1 | D.0.8 mol·L-1·s-1 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:v(正)>v(逆) |
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)==H2O ( l)
ΔH=-57.3 kJ / mol,分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
| A.ΔH1>ΔH2>ΔH3 | B.ΔH1<ΔH3<ΔH2 |
| C.ΔH1=ΔH2=ΔH3 | D.ΔH2<ΔH3<ΔH1 |
下列变化一定是吸热反应的是:
| A.凡需加热后才能发生的反应 | B.所有的分解反应 |
| C.将化学能转变为热能的反应 | D.生成物总能量大于反应物总能量的反应 |
沼气的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是:
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol |
| D.1/2 CH4(g)+ O2(g)=1/2CO2(g)+ H2O(g) △H=-890kJ/mol |