铝土矿的主要成分是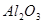 ,含有杂质
,含有杂质 、
、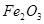 、
、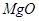 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是____________(填操作名称)。
(2)沉淀B的成分是____________(填化学式,下同),B可以用来制作普通玻璃,化学方程式是____________________,____________________;沉淀C的成分是____________;溶液D中存在较多的阴离子是____________。
(3)沉淀F转化为物质M的化学方程式为________________________;由物质M制取铝的化学方程式为________________________;溶液D中通入过量 生成沉淀F的离子方程式为________________________。
生成沉淀F的离子方程式为________________________。
某水溶液中含有等物质的量浓度的Cu(NO3)2和MgCl2,对该溶液以惰性电极进行电解,分阶段写出电解反应的化学方程式。
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路后,发现c点显红色,请填空:
为电镀槽。接通电路后,发现c点显红色,请填空:
(1)电源A上的a为极。
(2)滤纸B上发生的总化学反应方程式为。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为。电极f上发生的反应为,槽中盛放的电解液可以是或(只要求填写两种电解质溶液)。
A、B、C是三个电解槽,阳极均是Pt电极。A槽是CuCl2做电解液,纯铜片做阴极;B和C两槽以AgNO3溶液做电解液,纯银丝做阴极。先将A和B槽并联,再与C槽串联进行电解。若B槽中银丝质量增加0.108g,C槽银丝质量增加0.216g,则A槽中铜片增加的质量为_________________。
A、B、C、D、E五种物质之间的关系如下图所示,其中E为黑色物质,B为气体,C为金属,反应Ⅲ是C在D的稀溶液中进行的,则A为_______,B为______,D为______ 。
写出反应Ⅰ的离子方程式______________________________。
现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请完成下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为________________________________。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42+等杂质离子,使用的试剂有:
a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为________________(填试剂序号)。
(3)如果在容积为10 L的离子交换膜电解槽中,1 min在阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)________。
(4)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为________。