在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3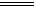 S↓+2NO2↑+2H2O S↓+2NO2↑+2H2O |
B.CuO+2HNO3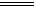 Cu(NO3)2+H2O Cu(NO3)2+H2O |
C.4HNO3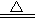 4NO2↑+O2↑+2H2O 4NO2↑+O2↑+2H2O |
D.3Cu+8HNO3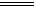 3Cu(NO3)2+2NO↑+4H2O 3Cu(NO3)2+2NO↑+4H2O |
下列说法正确的是
| A.光导纤维的主要成分是硅 | B.水晶项链是硅单质制品 |
| C.利用盐酸刻蚀石英制作艺术品 | D.硅酸钠是制备木材防火剂的原料 |
当光束通过下列物质时:①豆浆②稀硫酸③蒸馏水④淀粉溶液,没有丁达尔现象的分散系是
| A.②③④ | B.②④ | C.②③ | D.② |
下列物质中属于电解质且能导电的是
| A.Cu | B.NaOH溶液 | C.熔融Na2CO3 | D.乙醇 |
近年来,光化学烟雾污染问题已引起人们的注意,下列哪种气体是造成光化学烟雾的主要因素
| A.NO2 | B.SO2 | C.CO2 | D.Cl2 |
在C(s)+CO2(g)  2CO(g)反应可使反应速率增大的措施是
2CO(g)反应可使反应速率增大的措施是
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2
| A.①③⑤ | B.②④ | C.①③ | D.③⑤ |