八种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是
| 元素代号 |
A |
D |
E |
G |
Q |
T |
X |
Z |
| 化合价 |
-1 |
-2 |
+4、-4 |
-1 |
+5、-3 |
+3 |
+2 |
+1 |
| 原子半径/nm |
0.071 |
0.074 |
0.077 |
0.099 |
0.110 |
0.143 |
0.160 |
0.186 |
A.A、T、Z的离子半径由大到小的顺序是A>Z>T
B.A的单质能将G单质从TG3的溶液中置换出来
C.Q元素的单质不存在同素异形体
D.X在ED2中燃烧生成两种化合物
在相同温度下,在pH都是9的NaOH和CH3COONa两种溶液中,设由水电离产生的c(OH-)分别为amol/L与bmol/L,则a与b的关系为()
| A.a>b | B.a=10-4b | C.b=10-4a | D.a=b |
常温下,一定浓度的某溶液,由水电离出的c(OH-)=10-4mol/L,则该溶液中的溶质可能是()
| A.Al2(SO4)3 | B.CH3COONa | C.NaOH | D.KHSO4 |
已知25℃时,Ksp[Cu(OH)2]=2×10-20
(1)某CuSO4溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2。就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO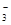 +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S===CuS↓+2H+ |
| C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑ |
| D.FeS+2H+===Fe2++H2S↑ |
已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1 HF溶液中pH=1 |
| B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中没有沉淀产生 |
| D.该体系中HF与CaCl2反应产生沉淀 |