常温下,0.1mol/L氨水中c(H+)/c(OH-)=1×10-10,下列说法正确的是
| A.溶液中由水电离出的c(OH-)=1×10-10mol/L |
| B.溶液中c(OH-)+c(NH3·H2O)=0.1mol/L |
| C.与0.1mol/L 的盐酸等体积混合后所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1mol/L |
| D.原溶液中加入少量的氯化铵晶体或加水稀释,溶液中的c(H+)均增大 |
随着碳原子数的增多,碳元素的质量分数也增大的是()
| A.烷烃 | B.烯烃 | C.炔烃 | D.苯的同系物 |
分子式为C5H7Cl的有机物,其结构不可能是()
| A.只含有1个双键的直链有机物 | B.含2个双键的直链有机物 |
| C.含1个双键的环状有机物 | D.含一个三键的直链有机物 |
下列说法中错误的是()
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
| A.①②③④ | B.只有②③ | C.只有③④ | D.只有①②③ |
既可发生消去反应,又能被氧化成醛的物质是()
| A.2-甲基-1-丁醇 | B.2,2-二甲基-1-丁醇 |
| C.2-甲基-2-丁醇 | D.2,3-二甲基-2-丁醇 |
下列各选项中两种粒子所含电子数不相等的是()
| A.羟甲基(-CH2OH)和甲氧基(CH3O-) | B.亚硝酸(HNO2)和亚硝酸根(NO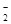 ) ) |
| C.硝基(-NO2)和二氧化氮(NO2) | D.羟基(-OH)和氢氧根(OH-) |