有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
第③个实验中,生成白色沉淀的量与加入NaOH的量有右图所示的相互关系。据此可知:
(1)在原溶液中一定不存在的离子有_______,
(2)在原溶液中一定存在的离子有_____________________
(3)写出第②第③个实验中发生反应的离子方程式
② ③ , , 。
[化学选修——2:化学与技术](15分)
海水是巨大的资源宝库,利用海水提取食盐的过程如图所示。回答下列问题: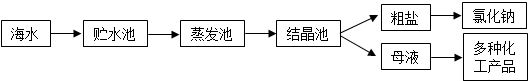
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液。加入试剂的顺序是。
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为,与电源负极相连的电极附近溶液pH的变化是。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱,①则气体B是(填化学式),由NaCl制取纯碱反应的化学方程为、 。
(3)采用空气吹出法从浓海水吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收3mol Br2时,转移的电子数为个。
(4)海水提镁的一段工艺流程如图: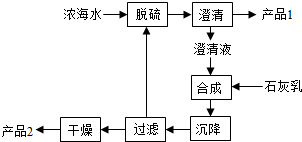
浓海水的主要成分如下:
| 离子 |
Na+ |
Mg2+ |
Cl- |
SO42- |
| 浓度/(g•L-1) |
63.7 |
28.8 |
144.6 |
46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为,1L浓海水最多可得到产品2的物质的量为mol。
(14分)汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图: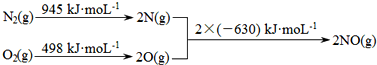
则该反应的热化学方程式为。
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。2xCO+2NOx ==2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下N2L。
(3)一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,还可以用来合成很多有机物如甲醇等。在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H= -bkJ•mol-1
CH3OH(g);△H= -bkJ•mol-1
①该反应的平衡常数表达式为。
②若容器容积不变,下列措施可增加甲醇产率的是。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和3 mol H2 |
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4 mol/L、c(H2)=0.4 mol/L、c(CH3OH)=0.8 mol·L-1,则此时v正v逆(填>、<或=)。
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池的正极反应式为_____________________________。电池工作时,固体电解质里的O2-向_______极移动。
(14分)硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红等产品的流程如下图所示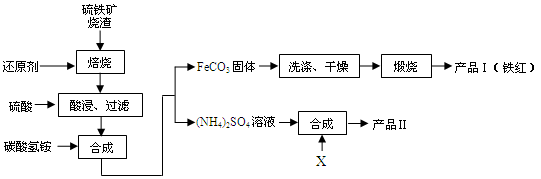
回答下列问题:
(1)若焙烧时还原剂碳燃烧产生的气体能将铁的多种氧化物还原成铁单质,则该气体与Fe2O3反应的化学方程式为。
(2)酸浸时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示为。
(3)加碳酸氢铵合成时反应温度一般需控制在35℃以下,其目的是。
(4)若产品Ⅱ的主要成分是K2SO4,则试剂X为,反应的离子方程式为。
(5)空气中煅烧FeCO3生成产品Ⅰ的化学反应方程式为。
(6)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,。
金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。在测定矿石中钒的含量时有如下操作: 用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液。
(1)完成滴定过程的离子反应方程式,方框内填数字,短线上填物质的化学式或离子符号。
VO2+ +H2C2O4 + ______→VO2+ +CO2 + ______
(2)当收集到标准状况下气体11.2升时,电子转移的数目为
(6分)某透明澄清溶液可能含有Na+、Fe3+、Ba2+、CO32-、SO32-、SO42-、Cl-、I-等离子中的几种,为鉴别这些离子,分别取三份少量溶液,按照以下顺序进行三个实验:
实验①:加CCl4,再滴加少量氯水,振荡后,CCl4层变为紫色;
实验②:加盐酸后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
实验③:加BaCl2溶液产生白色沉淀,过滤出沉淀,在沉淀中加入足量盐酸,沉淀不能完全溶解。
(1)分析上述3个实验,用离子符号写出每一个实验得出的结论,可不必完全填满。
实验①:含有;不含;
实验②:含有;不含;
实验③:含有;不含;(可不必完全填满)
(2)通过上述实验,不能确定是否存在的离子是。