孔雀石主要含Cu2(OH)2CO3〔也可认为是Cu(OH)2·CuCO3〕,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O,步骤如下:

|
请回答下列问题:(1)气体E的化学式是 。
(2)由溶液C获得CuSO4·5H2O,需要经过蒸发浓缩、冷却结晶、 和干燥等操作。请你根据下图回答下列问题: (1)指出下列编号仪器的名称:H、I;
(1)指出下列编号仪器的名称:H、I;
(2)用高锰酸钾制取氧气时选用的发生装置为(填编号),反应的化学方程式为
。实验时,还应在试管口放,以防止加热时高锰酸钾粉末进入导管,收集时选用的装置为 ,原因是
(3)硫化氢(H2S)是一种有毒气体,其密度比空气大,且能溶于水,水溶液呈酸性。实验室通常用硫化亚铁(FeS)与稀硫酸在常温下通过复分解反应制得。应该选择的最佳发生装置是(填编号),最好应该选择的收集装置是(填编号)。
(4)用D装置收集某种气体时,如何判断气体已收集满:;用E装置收集气体氧气时,如何判断已收集满?
(5)实验室制取二氧化碳时可选用的最佳发生装置是,如何检查它的气密性
,
可以选用的收集装置是;反应方程式为
(6)氨气(NH3)是一种无色、有刺激性气味,密度比空气小,极易溶于水的气体,其水溶液称为氨水。某课外兴趣小组同学用加热氯化铵和消石灰的固体混合物制取氨气,他们应选择的发生装置是,若选用G装置收集氨气,应从(选填“a”或“b”)通入,为防止多余的氨气逸出到空气中,应采取的措施是
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用下图所示装置进行实验,得到以下两组实验数据.
| 反应前 |
氧化铁完全反应后 |
|
| A组 |
玻璃管和氧化铁样品的质量43.7g |
玻璃管和固体物质的质量41.3g |
| B组 |
烧杯和澄清石灰水的质量180g |
烧杯和烧杯中物质的质量186.2g |
试回答:(1)你认为,应当选择 组实验数据来计算样品中氧化铁的质量分数,计算的结果为
(2)这位同学所用实验装置的不足之处是 .
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为 .
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的 .
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)装置A的作用是 .设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹, ;⑤再次称量装置C.计算碳酸钠含量至少需要测定 (填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因 .
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是 .
(6)使用冷水冷凝的目的是 .反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是 .
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是 (填字母序号).
A.100mL B.1L C.2L
(8)计算NaN3样品的纯度(写出计算过程).
下面是实验室制取氧气的装置图,根据装置图回答下列问题: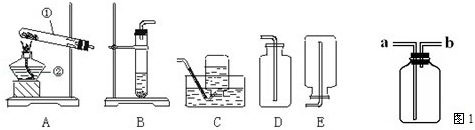
(1)写出装置图中标有①②序号的仪器名称:① ②
(2)实验室用氯酸钾制取氧气时的文字表达式 ,可选用的发生装置是 ;可选用的收集装置是 或 (写出装置代号).
(3)装置B是实验室用 和 制取氧气的发生装置.
(4)化学兴趣小组的同学经认真思考后,认为可选用图1装置进行收集氧气.若集气瓶中的气体是空气,那么进气口应是 (填“a”或“b”)如何验满
(5)已知氨气密度比空气小,易溶于水.实验室常用加热熟石灰和硫酸铵固体混合物来制取氨气,则制取氨气的发生装置是 ;收集装置是 ;(填写装置序号)
①暗紫色固体A在加热的条件下反应生成B和C以及D,②常温下过氧化氢溶液遇到C时分解放出D,其中C在反应前后的质量和化学性质都没有改变,③若将细铁丝放在D中点燃能剧烈燃烧,火星四射,生成黑色固体E.
(1)写出各物质的名称:
A ;B ;C ;D ;E .
(2)用文字表达式表示①、②、③有关的化学反应,并在括号内指出反应所属的反应类型(化合反应、分解反应)
① ;
② ;
③ .