.草酸亚铁晶体(FeC2O4·2H2O)常用作分析试剂及显影剂等。下图是将一定质量的草酸亚铁在氩气氛围中进行热重分析的示意图(TG%表示残留固体质量占原样品质量的百分数)。请回答下列问题:
(1)B处残留物的化学式为 。C处残留物的化学式为 。
(2)A→C整个反应过程中总反应的化学方程式为 。
(3)上述FeC2O4·2H2O在氩气气氛中进行热重分析的原因是 。
若将分解得到的600℃时的固体与足量的浓硫酸反应后,将溶液浓缩、冷却,有带9个结晶水的晶体析出,该晶体的化学式为 。
(4)现取1.44gFeC2O4放在某真空的密闭容器中,再充入0.04molCO,加热至1100℃,其中反应:FeO(s) + CO(g) 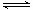 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: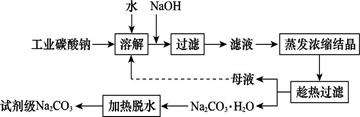
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: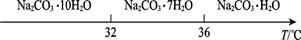
Ⅱ.有关物质的溶度积如下
| 物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=。
(2)“母液”中除了含有Na+、CO32—外,还含有等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行:(填“可行”或“不可行”),并说明理由:。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)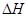 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g) ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲为非电解质。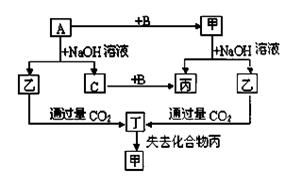
根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A B丁。
(2)元素A在周期表中的位置是,写出甲的一种用途。
(3)写出下列变化的方程式:
A与NaOH溶液反应的化学方程式
乙与过量CO2反应的离子方程式
A、B均为重要的有机化工原料。
已知: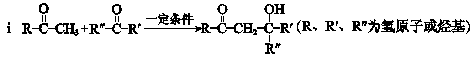
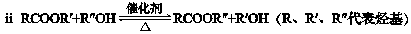
请回答下列问题:
(1)A分子内含有苯环,其名称是。
(2)B分子中只有一种氢原子,2 mol B反应生成1 mol C的化学方程式是:
。
(3)B的一种同分异构体能发生银镜反应,该反应的化学方程式是:
。
(4)D分子内有3个甲基,其结构简式是。
(5)F的结构简式是。F和L反应生成G是加成反应,L的结构简式。
(6)A与B反应生成J的化学方程式是。
(7)K分子内含有六元环,可发生水解反应,其结构简式是。
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是。
(2)滤渣A的成分是。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是。
(5)反应③的化学方程式是。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4
Li7Ti5O12+3FePO4
该电池充电时阳极反应式是。
铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
| 元素 |
钠 |
镁 |
铝 |
硅 |
| 电负性 |
0.9 |
1.2 |
χ |
1.8 |
①铝的电负性χ的范围是。
②电负性的数值与元素金属性的关系是。
③下列实验能比较镁和铝的金属性强弱的是。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s)ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s)ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”)极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是。