(选修—物质结构与性质)(12分)
X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。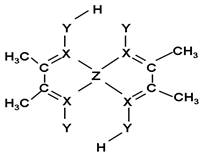
(1)Z原子的价层电子排布式为____________;XY3-离子的空间构型为__________。
(2)X单质与Y单质直接发生化合反应的化学方程式_________________________。
(3)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO_____ FeO(填“<”或“>” )。
(4)ZO晶体中Z2+的配位数为____________。
(5)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+
反应可生成鲜红色沉淀,其结构如图所示:
该结构中,碳碳之间的共价键类型是______(“σ键”
或“π键”);X与Z2+离子间形成的是配位键,在图
上标出配位键的电子给予的方向。
该结构中,Y原子与氢原子除了形成共价键外,
还可存在_______ ;
该结构中,碳原子的杂化轨道类型有_____;Y原子的杂化轨道类型为_____。
1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值: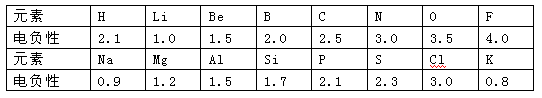
请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围:< X <。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
;简述元素电负性X的大小与元素金属性、非金属性之间的关系。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为。
在A、B、C、D四种元素中,A为地壳这含量最多的元素;B的单质在气体中密度最小;C元素的原子失去两个电子后,其电子层结构和氩原子相同;D元素的原子核外有三个能层,各能层电子数之比为1:4:1。
(1)写出上述四种元素的名称:A、B、C、
(2)写出C2+离子的电子排布式
(3)指出A、B、C三种元素中所形成的化合物中所包含化学键的类型
(10分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,
①原子序数为24的元素原子中有个能级,个价电子,个未成对电子。
②某元素原子的价电子构型为3S2,它是区元素,元素符号为。
用价层电子对互斥理论判断下列物质的空间构型:
① NH4+ ② NH3
③ CCl4④ SO3