.下列反应常温时能自发进行,并既能用焓判据又能用熵判据解释的是( )
| A.HCl+NH3=NH4Cl |
| B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.2KClO3=2KCl+3O2↑ |
D.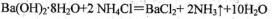 |
下列说法中用离子方程式表达正确的是
A.用惰性电极电解氯化钠溶液:2Cl-+2H+ H2↑+Cl2↑ H2↑+Cl2↑ |
| B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3 ↓+CO32- |
| C.Fe(NO3)2溶液中滴加少量稀盐酸:Fe2++NO3-+4H+=Fe3++NO↑+2H2O |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O |
下表各组物质中,物质之间不可能实现如图所示转化的是
| 选项 |
X |
Y |
Z |
M |
| A |
NH3 |
NO |
NO2 |
O2 |
| B |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
| C |
Al |
Al(OH)3 |
NaAlO2 |
NaOH |
| D |
NaOH |
Na2CO3 |
NaHCO3 |
CO2 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA |
| B.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA |
| C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| D.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA |
下列有关实验装置的说法中正确的是


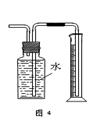
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe3+、Cl-、NO3-、K+ |
| B.滴入酚酞显红色的溶液中:Na+、Mg2+、AlO2-、NO3- |
| C.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO- |
| D.c(SO32-)=0.1 mol·L-1的溶液中:Na+、Cl-、H+、Ca2+ |