.一定温度下,将4mol PCl3和2mol Cl2充入容积不变的密闭容器中,在一定条件下反应: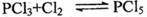 ,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和lmolCl2,相同温度下达到平衡,PCl5的物质的量为( )
,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和lmolCl2,相同温度下达到平衡,PCl5的物质的量为( )
| A.0.8mol | B.0.4mol | C.0.4mol<x<0.8mol | D.<0.4mol |
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,用C的浓度变化表示的平均反应速率为0.1 mol·L-1·min-1。下列有关结论正确的是
A.x的值为1
B.用B的浓度变化表示的平均反应速率为0.2 mol·L-1·min-1
C.反应开始前A的物质的量为3 mol
D.5 min时A的浓度为0.2 mol·L-1
反应速率v和反应物浓度的关系是用实验的方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用表中数据确定。
| c(H2)/mol·L-1 |
c(Cl2)/mol·L-1 |
v/[mol·L-1·s-1] |
| 1.0 |
1.0 |
1.0 k |
| 2.0 |
1.0 |
2.0 k |
| 2.0 |
4.0 |
4.0 k |
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=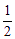 ,n=
,n=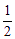 C.m=
C.m=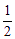 ,n=1 D.m=1,n=
,n=1 D.m=1,n=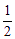
如图所示,甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。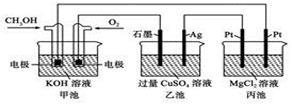
下列说法正确的是
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置 |
| B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |
可逆反应mA(s)+n D(g) pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T或压强p关系如图所示(D﹪为D的转化率),下列叙述中正确的是
pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T或压强p关系如图所示(D﹪为D的转化率),下列叙述中正确的是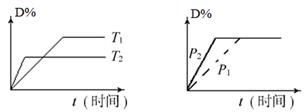
| A.正反应为放热反应 |
| B.使用催化剂,D的物质的量减小 |
| C.化学方程式系数m+n=p+q |
| D.增加物质A或D的用量,平衡均向右移动 |
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
| A.可用铁作为阳极材料 |
| B.电解过程中阳极附近溶液的pH升高 |
| C.阳极反应方程式为:2Cl- -2e-===Cl2↑ |
| D.1 moL 二价镍全部转化为三价镍时,外电路中通过了0.5 moL电子 |