下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+ |
B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2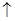 |
| C.将氯气溶于水制备次氯酸:Cl2+H2O===2H+ +CI-+ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4-+6H++5H2O2===2Mn2++5O2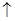 +8H2O
+8H2O
A元素的阴离子、B元素的阴离子和C元素的阳离子具有相同的电子层结构。已知A的原子序数大于B的原子序数。则根据元素周期律可知:A、B、C三种原子半径大小的顺序是
A.A > B > C B.B > A > C C.C > A > B D.C > B > A
可逆反应2SO2+O2 2SO3在密闭容器中达到了平衡,下列说法正确的是
2SO3在密闭容器中达到了平衡,下列说法正确的是
| A.SO2和O2不再化合,反应停止了 |
| B.容器内压强保持不变 |
| C.SO2、O2和SO3的浓度相等 |
| D.SO2、O2和SO3的物质的量之比为2:1:2 |
(1)反应A(g)+B(s) C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
①升温___;②增大压强____;③增大容器容积____;
④加入A___;⑤加入B____;⑥加正催化剂____。
(2)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________________________________________。
(3)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6),丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC
CH4(g)+HC CH(g)+H2(g)△H1="156.6" kJ·mol-1
CH(g)+H2(g)△H1="156.6" kJ·mol-1
CH3CH CH2(g)
CH2(g) CH4(g)+HC
CH4(g)+HC CH(g )△H2="32.4" kJ·mol-1
CH(g )△H2="32.4" kJ·mol-1
则相同条件下,反应C3H8(g) CH3CH
CH3CH CH2(g)+H2(g) 的△H=kJ·mol-1。
CH2(g)+H2(g) 的△H=kJ·mol-1。
(4)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 |
C—H |
C—F |
H—F |
F—F |
| 键能 |
414 |
489 |
565 |
158 |
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g)△H=______________________
在一密闭容器中进行如下反应:2SO2(气)+O2(气) 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.25mol/L |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡
R(g)+S(g)在恒温下已达到平衡
| A.反应容器内的P、Q、R、S的浓度不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |