某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同的离子):Ag+、Ba2+、Fe3+、Na+、SO42-、NO3-、OH-、Cl-。两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清的只含硝酸钠而排放,污染程度大大降低。关于污染源的分析,你认为正确的是
| A.SO42-和NO3-可能来自同一工厂 | B.Cl-和NO3-一定在相同的工厂 |
| C.Ag+和Na+可能来自同一工厂 | D.Na+和NO3-一定来自不同的工厂 |
在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是
A.3:2 |
B.2:1 | C.1:1 | D.2:3 |
根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为
| A.Na2SO4 | B.SO2 | C.S | D.Na2S |
将CoCl2溶解于盐酸中可以形成CoCl42—,在溶液中存在下面的化学平衡:
Co2+(aq)+4Cl-(aq)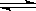 CoCl42—(aq) ΔH>0
CoCl42—(aq) ΔH>0
粉 红色蓝色
红色蓝色
下列说法正确的是
A.升高温度,正 反应速率增大,逆反应速率减小 反应速率增大,逆反应速率减小 |
B.该反应的平衡常数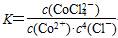 |
| C.将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色 |
| D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)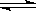 C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则
A.a=3 |
B.a=2 |
| C.B的转化率为40% | D.B的转化率为60% |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g)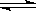 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表 达式是 达式是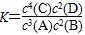 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |