已知反应X+Y=M+N为放热反应,,对该反应的下列说法中正确的( )
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因该反应为放热反应,故不必加热就可发生 |
甲、乙两瓶稀氨水的浓度分别是1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)之比为
| A.大于10 | B.小于10 | C.等于10 | D.无法确定 |
曲线a表示 2X(g) + Y(g) 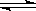 Z(g) + 2M(g) +3 N(s);?H<0 ,进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + 2M(g) +3 N(s);?H<0 ,进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
| A.升高温度 | B.加大X的投入量 |
| C.扩大容器体积 | D.缩小容器体积 |
己知:HCN(aq)与NaOH(aq)反应的∆H= —12.1kJ/mol;HCl(aq)与NaOH(aq)反应的
∆H= —55.6kJ/mol。则HCN在水溶液中电离的∆H等于
| A.—67.7 kJ/mol | B.—43.5 kJ/mol | C.+43.5 kJ/mol | D.+67.7kJ/mol |
下列反应的离子方程式书写正确的是
| A.CH3COOH溶液与NaOH溶液反应:CH3COOH + OH— = CH3COO— + H2O |
B.硫氢化钠水解:HS— + H2O 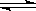 H3O+ + S2— H3O+ + S2— |
| C.NaHCO3溶液与NaOH溶液反应:HCO3— + OH— = CO2↑ + H2O |
| D.FeCl3溶液与Na2S溶液反应:2Fe3+ + 3S2— + 6H2O = 2Fe(OH)3↓ + 3H2S↑ |
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X + 2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为5:2,则Y的转化率最接近于
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为5:2,则Y的转化率最接近于
| A.33% | B.40% | C.50% | D.65% |