用NA表示阿伏加德罗常数,下列说法正确的是 ( )
①25℃时,PH=13的1.0L Ba(OH)2溶液中含有的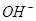 数目为0.2NA
数目为0.2NA
②1mol Na2O2与水完全反应时转移电子数为2 NA;
③6.8g熔融的KHSO4中含有的阳离子数为0.05 NA
④在标准状况下,22.4LSO3的物质的量为1mol;
⑤7.8g过氧化钠中含有的离子数为0.3 NA;
⑥由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2 NA
⑦200mL1mol/LFe2 (SO4) 3溶液中,Fe3+和SO42-离子数的总和是NA
⑧1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
⑨标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5 NA
⑩室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
| A.①③⑤⑥ | B.③⑤⑥⑩ | C.②④⑥⑦ | D.③④⑤⑨ |
下列颜色变化与氧化还原反应无关的是
| A.将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 |
| B.将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 |
| C.将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去 |
| D.将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
下列实验装置或操作正确的是
| A |
B |
C |
D |
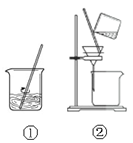 除去附着在铁屑 除去附着在铁屑表面的铝 |
 实验室制取乙酸乙酯 |
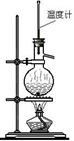 实验室制乙烯 |
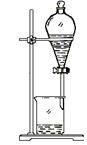 分离酒精和水 |
解释下列事实的方程式正确的是
A.加热可增强纯碱溶液去污力:CO32-+2H2O H2CO3+2OH- H2CO3+2OH- |
| B.用稀硝酸洗涤做过银镜反应的试管:Ag + 4H+ +NO3—= Ag++ NO↑++2H2O |
| C.向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+ O2+2SO2=2CO2+2CaSO4 |
| D.碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-=CaCO3↓+H2O |
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
| A.c(H+)= c(CH3COO-)+ c(OH-) |
| B.加入少量CH3COONa固体后,c(CH3COO-)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
下列图示内容的对应说明错误的是
| A |
B |
C |
D |
|
图示 |
 |
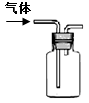 |
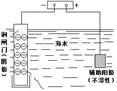 |
 |
| 说明 |
主要成分是蔗糖 做 调 味 剂 |
该装置可以收集 二氧化氮 |
该装置可保护钢 闸门不被腐蚀 |
该仪器用于配制一定质量分数的溶液 |