1834年德国科学家米希尔里希通过蒸馏苯甲酸和石灰的混合物得到苯。苯是重要的化工原料。结合所学知识完成下列各题。
(1)下列实验结论能够证明凯库勒式与苯的真实结构不相符的是 。
A.在一定条件下1mol苯能与3mol氢气发生加成反应
B.苯不能使酸性KMnO4溶液褪色
C.苯的邻二溴代物没有同分异构体
D.经测定苯为六边形结构,且所有碳碳键完全相同
(2)苯酚也是重要的化工原料,某实验小组以苯为原料制取苯酚,进而合成高分子化合物。请根据下列合成反应流程图填写A、B、C、D、可能的结构简式及①、②、③的反应条件。
A: B: C:
D: ①:
②: ③:
W、M、X、Y、Z、Q是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色。六种元素核电荷数之和为71,W、Q最外层电子数相同,Q的核电荷数是W的2倍。Z的单质和氧化物均为原子晶体。工业上一般通过电解氧化物的方法获得Y的单质。请回答下列问题:
(1)Y的离子结构示意图_____________;M元素在元素周期表中的位置为_______________。
(2)写出电子式并在括号内指出所含化学键的类型:W的单质_____________();
X与W按原子个数比2:1形成的化合物 _____________().
(3)W、M、X、Y、Z、Q原子半径由小到大的顺序为_____________________(用元素符号表示)。
(4)W、M、Q形成的氢化物的稳定性__________________________(用氢化物分子式表示)
Z元素氢化物的分子空间构型___________________。
(5)X、Y、Q的最高价氧化物对应的水化物之间两两均可反应,写出反应的离子方程式,
________________________,________________________,______________________;
(6)写出一个化学反应方程式,证明下列结论:
非金属性M比W强:__________________________________________________________;
非金属性Q比Z强:______________________________________________________________。
(6分)下列物质中:
(1)互为同分异构体的有(2)互为同素异形体的有
(3)属于同位素的有(填序号)
①液氯② ③白磷④氯气⑤
③白磷④氯气⑤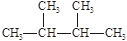
⑥ Cl⑦
Cl⑦ Cl⑧红磷
Cl⑧红磷
下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题: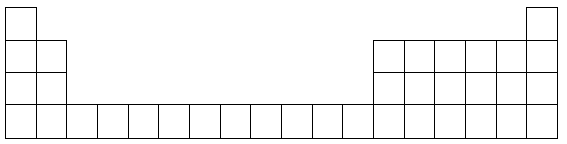
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有(填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有_______种,属于d区的元素有_______种。第二周期元素中除Ne外电负性由高到低的三种元素依次是_______,电离能由高到低的三种元素依次是_______。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 |
Mn |
Fe |
|
| 电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:_____________________________
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
OC段,
DE段,
EF段_____________________________________________。
(2)硝酸溶液的物质的量浓度为mol·L-1
(3)B的值为_________mol,C的值为mL。
某溶液仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
阳离子:Na+ Mg2+ Fe3+ Al3+ Fe2+
阴离子:OH- CO32- Cl- NO3- SO42-
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变;请推断:
(1)原溶液中含有阳离子:________;含有阴离子:__________;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式:______ ____;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为__________g。