氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是
| A.4NH3 +5O2 =4NO+6 H2O |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl +Br2 |
将4mol金属Al全部转化为Al(OH)3,共消耗HClamol,NaOHbmol,则(a+b)的最小值为
| A.4mol | B.6mol | C.8mol | D.16mol |
下列化学用语使用正确的一组是
①氨基乙酸 ②蒸馏烧瓶 ③二氧化碳电子式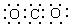 ④3—甲基丁烷 ⑤坩锅钳 ⑥乙稀
④3—甲基丁烷 ⑤坩锅钳 ⑥乙稀
⑦过氧化氢电子式 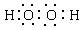 ⑧三角椎形 ⑨溶量瓶 ⑩银铵溶液
⑧三角椎形 ⑨溶量瓶 ⑩银铵溶液
| A.①⑤⑦⑧ | B.②③⑦⑩ | C.①②⑦ | D.②④⑥⑨ |
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是()
| A.加入适量的氯化铵晶体后,两溶液的pH均减小 | B.温度下降10oC,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 | D.用盐酸中和,消耗的盐酸体积相同 |
可逆反应aA(?)+2 B(g) 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( ) 
| A.达到平衡后,加入催化剂则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意的正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
常温条件下,将SO2气体通入一定量NaOH溶液中,所得溶液呈中性,关于该溶液的判断错误的是( )
| A.该溶液溶质一定为NaHSO3与Na2SO3 | B.溶液中c(Na+)=c(SO32—)+c(HSO3—) |
| C.溶液中离子浓度最大的是Na+ | |
| D.向该溶液中加入氯化钾固体,溶液依然呈中性,且有c(K+)=c(Cl—) |