下列说法正确的是 ( )
| A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
将一溴丙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果没有看到浅黄色沉淀生成,其主要原因是
| A.加热时间太短 | B.不应冷却后再滴入AgNO3溶液 |
| C.加AgNO3溶液前未用稀HNO3酸化 | D.加AgNO3溶液后未加稀HNO3 |
某烃能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,它的分子式为C8H10。且该有机物苯环上的一氯代物只有2种,则该烃是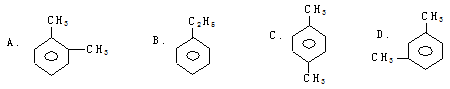
某有机物的结构简式为 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是
| A.2—丁炔 | B.2—甲基—1,3—丁二烯 |
| C.1,3—丁二烯 | D.1,4—二氯—2—甲基—2—丁烯 |
下列混合物应选用蒸馏操作法分离的是
| A.硝酸钾和氯化钠的混合物 | B.溴水 |
| C.汽油和柴油 | D.四氯化碳和水 |
在t℃时,10L 0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
| t /min |
0 |
2 |
4 |
6 |
| V(O2)/L |
0.0 |
9.9 |
17.2 |
V=? |
下列叙述正确的是(溶液体积变化忽略不计)
A.0~2min H2O2平均反应速率比4~6min慢
B.反应至6min时,共产生O2 44.8L
C.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
D.反应至6min时,c(H2O2) = 0.3mol·L-1