已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 |
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是()
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.②④ | B.②③ | C.①② | D.③④ |
向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH =4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO22-)。其平衡关系如下:
Cr3++3OH- Cr(OH)3
Cr(OH)3 CrO22- + H+ + H2O
CrO22- + H+ + H2O
(紫色)(灰绿色)(亮绿色)
向0. 05mo1·L-1 Cr2(SO4)3溶液50mL中,加入1.0mol·L-1NaOH溶液50mL,充分反应后,溶液中可观察到的现象是()
| A.溶液为紫色 | B.溶液中有灰绿色沉淀 |
| C.溶液为亮绿色 | D.无法判断 |
下列实验基本操作正确的是()
| A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL; |
| B.配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量 |
| C.用广范PH试纸测某 溶液PH=3.6 |
| D.用玻璃棒蘸取溶液滴到湿润的pH试纸上,测其pH |
下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是()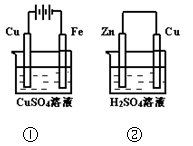
| A.在①中Cu棒为阳极;在②中Cu棒为负极 |
| B.电极上生成物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
关于小苏打水溶液的表述正确的是()
| A.c (Na+)="c" (HCO3-) + c (CO32-) + 2c (H2CO3) |
| B.c (Na+) + c (H+) =" c" (HCO3-) +c (CO32-) +c (OH-) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
D.存在的电离有:NaHCO3=Na++HCO3—,HCO3—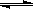 H++CO32—, H++CO32—, |
H2O 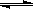 H++OH—
H++OH—