一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 =" 2" CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是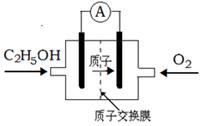
| A.放电过程中,电源内部的H+从正极区向负极区迁移 |
| B.通入乙醇的电极是负极 |
C.该电池的正极反应为:4H+ + O2 + 4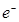 = 2H2O = 2H2O |
| D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
把6 mol A气体和5 mol B气体混合放入4 L密闭容器中,在一定条件下发生反应:
3A(g)+B(g) 2C(g)+xD(g)。经5 min达到平衡,此时生成2 mol C,测定知D的平均反应速率为0.1 mol/(L·min),下列说法中错误的是
2C(g)+xD(g)。经5 min达到平衡,此时生成2 mol C,测定知D的平均反应速率为0.1 mol/(L·min),下列说法中错误的是
| A.x=2 |
| B.B的转化率为20% |
| C.平衡时A的浓度为0.75 mol/L |
| D.恒温达到平衡时容器内压强为开始时的85% |
对于可逆反应:2AB3(g) 2A(g)+3B2(g) ΔH>0 ,下列选项中不正确的是
2A(g)+3B2(g) ΔH>0 ,下列选项中不正确的是
下列根据反应原理设计的应用,不正确的是
A.CO32—+H2O HCO3—+OH-;用热的纯碱溶液清洗油污 HCO3—+OH-;用热的纯碱溶液清洗油污 |
B.Al3++3H2O Al(OH)3(胶体)+3H+;明矾净水 Al(OH)3(胶体)+3H+;明矾净水 |
C.TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl;制备TiO2纳米粉 TiO2·xH2O↓+4HCl;制备TiO2纳米粉 |
D.SiCl2+H2O Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入NaOH Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入NaOH |
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应
A(g)+2B(g) C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体的总物质的量⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A.①②③④⑤⑥⑦⑧B.①③④⑤
C.①②③④⑤⑦D.①③④⑤⑧⑨
下列说法正确的是
| A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大 |
| B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小 |
| C.活化分子间发生的碰撞为有效碰撞 |
| D.使用催化剂,活化分子百分数增多,化学反应速率增大 |