下列离子方程式中,正确的是( )
A.氯气通入水中,溶液呈酸性:Cl2 + H2O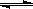 2H+ + Cl- + ClO- 2H+ + Cl- + ClO- |
| B.酚酞滴入碳酸钠溶液中,溶液变红:CO32- + H2O=HCO3- + OH- |
| C.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4+ + OH-=H2O + NH3↑ |
| D.二氧化硫通入溴水中,溴水褪色:SO2 + Br2 + 2H2O=4H+ + 2Br- + SO42- |
下列化学用语正确的是
A.HCl的电子式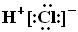 |
B.Cl-的结构示意图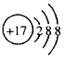 |
C.CO2的电子式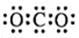 |
D.质量数为37的氯原子17 37Cl |
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.放热的反应在常温下一定易进行 |
| C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的 |
| D.吸热反应必须在加热条件下才能进行 |
右图是氢氧燃料电池(电解质为KOH)构造示意图。关于该电池的说法不正确的是()
| A.a极是负极 |
| B.正极的电极反应是:O2+2H2O+4e-=4OH- |
| C.电子由b通过灯泡流向a |
| D.氢氧燃料电池是环保电池 |
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是 ()
| A.X的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热,反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
在反应:C+CO2=2CO中,可使反应速率增大的措施是()
①增大压强②升高温度③通入CO2④增加碳的量⑤降低压强
| A.①②③ | B.②③④⑤ | C.①②③④ | D.②③④ |