氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
⑴写出基态铬原子的外围轨道表示式_______________________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为________。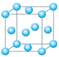
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子。
⑶在①苯、②C2H4、③CCl4、④CO2五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CO2分子的空间构型是______________。
有A、B、C、D、E四种短周期元素,原子序数依次增大,在周期表中B与C相邻、D与E相邻。已知A原子的电子层数与它的核外电子总数相同。B元素的氢化物与E元素的氢化物反应只生成一种盐;C、D位于同一族,它们能组成DC2、DC3两种常见化合物。请回答下列问题:
(1)C是________,D是____________,E是____________(填元素名称)。
(2)由A、B、C中的两种元素组成,且与A2C分子具有相同电子数的两种阳离子是________和________(写化学式)。
(3)D与E可形成共价化合物D2E2,分子中D与E均满足8电子稳定结构,则D2E2的电子式为_______。
(4)A、B、C可以形成一种盐,此盐中A、B、C元素的原子的个数比为4:2:3,该盐的化学式是____________。该盐受热可产生B的单质和B的最高价氧化物的水化物,对应化学方程式是____________。
(5)A、B可以形成一种离子化合物,电子式是____________
(10分)已知10.4 g某有机物X在空气中完全燃烧,所得产物先后通过足量的浓硫酸和碱石灰,分别增重7.2克和35.2克。物质X在不同条件下能发生如下图所示的一系列变化。
注:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物)
(1)X的化学式:________,X的结构简式:________ ,C的结构简式:。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出D―→E反应的化学方程式。
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)基态Cu2+的核外电子排布式为。
(2)根据价层电子对互斥模型(VSEPR),PO43-离子内中心原子价层成键电子对和孤电子对之和为,离子的空间构型是。
(3)液氨分子间存在自耦电离:2NH3 NH2-+NH4+,NH2-中氮原子轨道的杂化类型是,H+易与NH3形成NH4+,配位键的解释是。
NH2-+NH4+,NH2-中氮原子轨道的杂化类型是,H+易与NH3形成NH4+,配位键的解释是。
(4) 胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有。(填序号)
胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有。(填序号)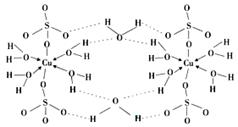
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,Cu2+的配位数为,1mol CN-中含有的π键的数目为。
化合物C是某合成路线的中间体,可通过下列方法合成:
回答下列问题:
(1)在催化剂作用下,A与氢气反应的化学方程式为,反应类型为。
(2)B的结构简式为,所得B的粗产品通常用的方法提纯。
(3)在C的制备中,浓硫酸的作用是。
下图I中表示在2L的密闭容器中、T1温度下,某可逆反应各物质浓度与时间关系;图II表示当其它条件不变时,C物质的体积分数(C%)与温度(T)和压强(p)的关系。回答下列问题: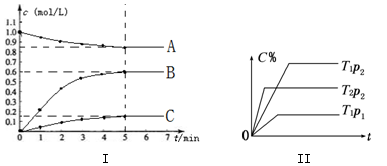
(1)该可逆反应的化学方程式为。
(2)上述反应的压强p1p2,反应的焓变△H0(填“大于”、“小于”或“等于”)
(3)若温度T1时,5min后反应达到平衡,则
①平衡时体系总的物质的量为。
②反应的平衡常数K=。(列式计算)
③反应在0~5min区间的平均反应速率v(B)=。