(11分)根据废水中所含有害物质的不同,工 业上有多种废水的处理方法。
业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为 。
③废水III中的汞元素存在如下转化:
Hg2++ CH4 =CH3Hg++H+,我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+ 3×10-7mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr207溶液的仪器是 。(酸式滴定管或碱式滴定管)
②Ⅱ中,碎瓷片的作用是 。
③III中,发生的反应为:Cr2O2-7+6Fe2++14 H+=2Cr3++6Fe3++7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
(12分)图表法、图象法是常用的科学研究方法。请回答以下问题
(1)第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。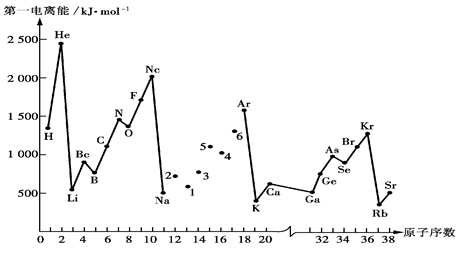
①将Na—Ar之间六种元素用短线连接起来(不必写在答题卷上),构成完整的图像。从上图分析可知,同一主族元素原子的第一电离能I1变化规律是;__________________
_________________________________________________________________________
②上图折线中数字5代表元素在周期表中的位置是___________________________;
(2)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:试结合元素周期律知识完成下列问题:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
①经验规律告诉我们: 当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是____________________(填离子键或共价键)。
②某有机化合物分子中含有S—N键,你认为该共用电子对偏向于____________原子(填元素符号)。
(3) 已知:波长为300nm的紫外光的光子所具有的能量约为399 kJ/mol。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:_______________________________________________________________。
请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有______(填元素符号),
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2 分子的键角是__________。
分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如 [Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
[Co(H2O)6]2+显粉红色。其中Co2+的价电子排布式为________________________
(4)利用CO可以合成化工原料COCl2,其中
①COCl2分子的结构式为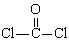 ,②COCl2分子内含有(填标号);
,②COCl2分子内含有(填标号);
A.4个σ键 B.2个σ键、2个π键
C.2个σ键、1个π键D.3个σ键、1个π键
下表为长式周期表的一部分,其中的编号代表对应的元素。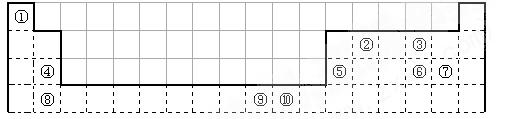
请回答下列问题:
(1)表中属于ds区的元素是(填编号)。
(2)元素②与③形成的一种化合物是重要的化工原料,该化合物能使澄清石灰水变浑浊。有关该化合物分子的说法正确的是。
| A.分子中含极性共价键 | B.属于非极性分子 |
| C.含有1个σ键和2个π键 | D.该化合物分子中,②原子采用sp2杂化 |
(3)根据上述表格 中的十种元素填空:
中的十种元素填空:
I、金属性最强的主族元素是_____________(填元素名称);
II、⑤、⑥、⑦的离子半径由小到大的顺序是_______________________(填化学式)
III、⑥、⑦两种元素的最高价氧化物对应的水化物的酸性由大到小的顺序是 _________
_________
(填化学式),
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_____________;该元素与元素①形成的分子X的空间构型为。
按要求填空
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意 图是,第一电离能最小的元素的原子轨道表达式_______________________。
图是,第一电离能最小的元素的原子轨道表达式_______________________。
(2)第四周期元素中,4p轨道半充满的元素是_____________(填元素符号)
价电子层中s电子数与d电子数相同的元素是(填元素名称)。
(3)中国古代四大发明之一――黑火药,它的爆炸反应方程式为:
2KNO3+3C+S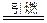 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除K、S外,上述方程式中出现的元素形成氢化物的稳定性从大到小依次为_____。
②写出K的基态电子排布式_____________________ _________________
_________________
抗击“非典”期间,过氧乙酸(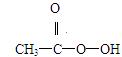 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4-+□H2O2+□H+=□Mn2++□O2十□H2O
② H2O2+2 +2H+= I2+2H2O
+2H+= I2+2H2O
③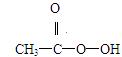 +2
+2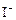 +2H+= CH3COOH+I2+H2O
+2H+= CH3COOH+I2+H2O
④ I2+2S2O32-= 2I-+S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
MnO4-+H2O2+H+="==" Mn2++O2十H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是________________________
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标
的Na2S2O3标 准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ___________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)