下列各组元素的原子随着原子序数的递增,有关递变不正确的是
| A.最高正价:P<S<Cl<Ar | B.金属性:Na<K<Rb<Cs |
| C.原子半径:C>N>O>F | D.最外层电子数:Na<Mg<Al<Si |
一定温度下,可逆反应3X(g)+Y(g)  2Z(g)达到限度的标志是
2Z(g)达到限度的标志是
| A.X、Y、Z的浓度相等 |
| B.X的生成速率与Z的生成速率相等 |
| C.X、Y、Z的分子个数比为3:1:2 |
| D.单位时间内生成3n mol X,同时消耗n mol Y |
在恒温恒容的容器中进行反应A(g)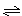 2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06 mol·L-1降到0.02mol·L-1,需要反应的时间是
2B(g)+C(g),若反应物浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06 mol·L-1降到0.02mol·L-1,需要反应的时间是
| A.等于20s | B.等于12s | C.大于20s | D.小于12s |
在N2+3H2 2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是
2NH3反应中,自反应开始至2s末,氨的浓度由0变为0.4 mol·L-1,则以氢气的浓度变化表示该反应在2s内的平均反应速率是
| A.0.3 mol·L-1·s-1 | B.0.4 mol·L-1·s-1 |
| C.0.6 mol·L-1·s-1 | D.0.8 mol·L-1·s-1 |
第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示。下列叙述中正确的是


| A.通入空气的电极发生氧化反应 |
| B.通入氢气的电极为正极 |
| C.正极的电极反应式为:O2+4H+-4e-==2H2O |
| D.总反应式为:O2+2H2==2H2O |
100ml2mol/L的稀硫酸与过量的锌反应,为加快反应速率,又不影响氢气的总量,可采用的方法是
| A.不用稀硫酸,改用98﹪浓硫酸 | B.加入数滴氯化铜溶液 |
| C.加入适量的蒸馏水 | D.加入更多锌片 |