已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是
| A.黑色粉末X是铁粉 |
| B.铜电极连接电源正极 |
| C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O |
D.铜的相对原子质量的计算式是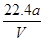 |
在0 .1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH
.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+
CH3COO-+H+
对于该平衡,下列叙述正确的是
| A.加入水时,平衡向正反应方向移动,pH减小 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列说法正确的是()
| A.某物质的溶解性为难溶,则该物质不溶于水 | B.不溶于水的物质溶解度为0 |
| C.绝对不溶解的物质是不存在的 | D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
下列热化学方程式中△H代表燃烧热的是()
| A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g )△H1 |
| B.S ( s ) + 3/2O2 ( g ) = SO3 ( s )△H2 |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l )△H3 |
| D.2CO ( g ) + O2 ( g ) = 2CO2 ( g )△H4 |
一定条件下反应2AB(g) 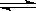 A2(g)+B2(g)达到平衡状态的标志是()
A2(g)+B2(g)达到平衡状态的标志是()
A.单位时间内生成nmolA2,同时消耗 2n molAB B.容器内,3种气体AB、A2、B2共存
C .AB的消耗速率等于A2的 消耗速率 D.容器中各组分的体积分数不随时间变化
消耗速率 D.容器中各组分的体积分数不随时间变化
A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极,则A、B、C三种金属的活动性顺序为()
A.A>B>C B.A>C>B C.B>A>C D.B>C>A