已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是
A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
下列实验方案不合理的是( )
| A.除去乙烷中含有的乙烯:将气体通入溴水中,洗气 |
| B.检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸。水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象。 |
| C.除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热 |
| D.鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯中 |
下列各选项中两种粒子所含电子数不相等的是( )
| A.羟甲基(-CH2OH)和甲氧基(CH3O-) |
| B.亚硝酸(HNO2)和亚硝酸根(NO2-) |
| C.硝基(-NO2)和二氧化氮(NO2) |
| D.羟基(-OH)和氢氧根(OH-) |
在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为( )
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为( )
A.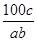 ×100% ×100% |
B.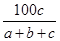 ×100% ×100% |
C.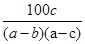 ×100% ×100% |
D. % % |
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
| A.υ(X)=0.05mol·L—1·min—1 | B.υ(Y)= 0.10mol·L—1·min—1 |
| C.υ(Z)=0.10mol·L—1·min—1 | D.υ(W)=0.05mol·L—1·s—1 |
下列用水就能鉴别的一组物质是( )
| A.苯、己烷、四氯化碳 | B.苯、乙醇、四氯化碳 |
| C.硝基苯、乙醇、四氯化碳 | D.硝基苯、乙醇、乙酸 |