“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。下图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:
| A.稀硫酸; | B.锌粒; |
| C.某溶液; | D.CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水 |

请回答下列问题:
⑴反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是 。
⑵装置D中的离子方程式 ,该反应的类型是 ,
装置F中的离子方程式 。
⑶上图B~F装置中发生氧化还原反应的是 (填编号)。
用单线桥表示出电子转移 。
孔雀石的主要成分为Cu2(OH)2CO3还含少量二价铁和三价铁的氧化物及硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图: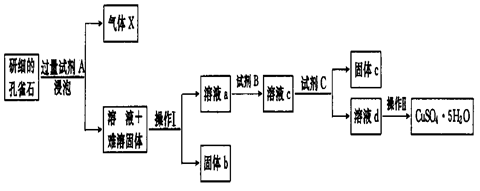
(1)试剂A的化学式是__________;操作I的名称是_________;操作Ⅱ用到的仪器有
酒精灯、玻璃棒、_________、坩埚钳和三角架。
(2)生成气体X的化学方程式为 。
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用_______(填选项序号)。
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
写出相应反应的离子方程式:。
(4)已知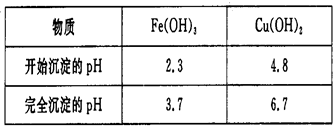
试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂C宜选用 ___________(填选项序号);
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为_________。
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)______。
无水CuSO4在一定条件下发生如下反应:
有人设计通过实验测定反应生成的SO3、SO2和O2,并经过计算确定该条件下分解反应方程式各物质的化学计量数,实验所需仪器装置如图所示。
实验测得数据及有关结果如下:
①准确称量无水CuSO46.0g。
②测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml。
③干燥管中的质量在实验结束时增加了3.2g。
④实验结束时,装置F中的溶液变成Na2SO4溶液(不含其他杂质)。
请回答如下问题:
已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b
(1)装置F的作用是_____________,装置D的作用是_______________。
(2)首先应计算的物质是______________。
通过计算推断,该条件下反应的化学方程式是_____________________。
(3);(填序号)____________。
“化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生。下图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:
| A.稀硫酸; | B.锌粒; | C.某溶液; | D.CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水 |

请回答下列问题:
⑴反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是(填名称)。
⑵写出下列装置中发生反应的离子方程式: 装置D中:
装置D中: 装置F中:
装置F中:
⑶上图所示的B~F装置中,发生了氧化还原反应的是(填装置编号)。
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品,将样品配成250mL待测液时需要的玻璃仪器有。
(2)取10.00mL待测液,用量取。
(3)用0.2000 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时手旋转式滴定管的玻璃活塞,手不停地摇动锥形瓶,两眼注视,直到滴定终点。
(4)根据下表数据,计算待测烧碱溶液的浓度:。
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是、。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是。
(3)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
| t1 |
t2 |
||||
| ① |
50mL 0.55mol.L-1NaOH |
50mL 0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL 0.55mol.L-1NaOH |
50mL 0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=cm(t2 -t1),反应后溶液的比热容c为4.18J·℃-1· g-1,各物质的密度均为1g·cm-3。
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式(△H值精确到小数点后2位):
(4)若用KOH代替NaOH,对测定结果(填“有”或“无”)影响。