下列各组微粒属于等电子体的是( )
| A.C2H2和N2 | B.NO和NO2 |
| C.CH4和NH3 | D.CO2和N2O |
下列实验方案设计正确的是( )
| A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用(NH4)2CO3溶液作鉴别试剂 |
| C.用铜丝代替铂丝做焰色反应 |
| D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物 |
关于下列各实验装置的叙述中,正确的是( )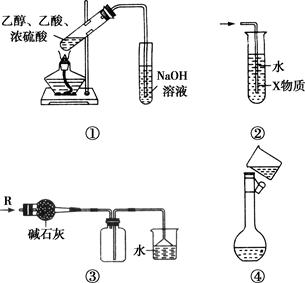
| A.装置①制备乙酸乙酯 |
| B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| C.装置③可用于干燥,收集Cl2,并吸收多余的Cl2 |
| D.装置④配制一定物质的量浓度的溶液时转移液体 |
下列实验操作正确的是( )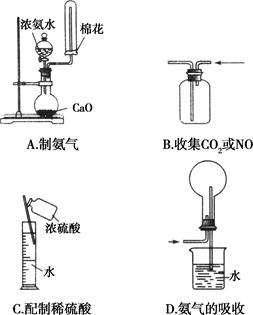
图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )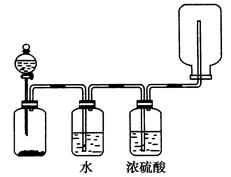
| A.锌和盐酸生成氢气 |
| B.亚硫酸钠和浓硫酸生成二氧化硫 |
| C.碳酸钙和盐酸生成二氧化碳 |
| D.浓氨水和烧碱制取氨气 |
下列制备和收集气体的实验装置合理的是( )