目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)下图中配合物分子内的作用力有 (填编号)。
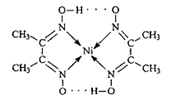
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
|
①CH2=CH2、 ②CH≡CH、 ③ 、④HCHO等,其中分子属于平面结构的有
(填物质序号),预测HCHO分子的立体结构为 形。
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下: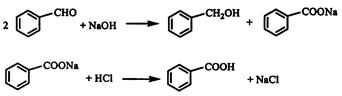
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高 于250℃
于250℃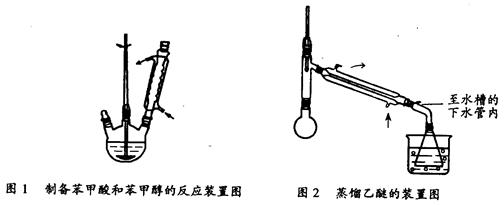
实验步骤如下:
① 向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。反应物冷却至室温后,用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤,分液水层弃去所得醚层进行实验③。
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A。
④实验步骤②中保留待用水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需(仪器名称),实验前对该仪器进行检漏操作,方法是________________________________。
(2)饱和亚硫酸氢钠溶液洗涤是为了除去,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生原因___________________________。
(3)步骤③中无水硫酸镁是剂;产品A为
(4)蒸馏除乙醚的过程中采用的加热方式为;蒸馏得产品A加热方式是_______________;蒸馏温度高于140℃时应改用_________________冷凝。
(5)提纯产品B 所用到的实验操作为。
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1= —393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2= —483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的△H=kJ·mol-1。
标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移______mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为;
则该电池的正极反应式是。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。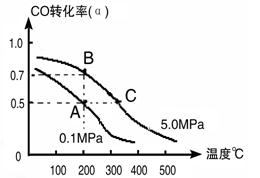
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是。
平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物)。②Al3+在pH=5.0时沉淀完全; Mg2+在p H=8.8时开始沉淀,在pH=11.4时沉淀完全。
H=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
I.向一定量的X粉末中加入45.0mL的2mol/L盐酸溶液中,恰好完全反应并收集到112mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调 节pH至5~6,产生白色沉淀B,过滤。
节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。沉淀物进行洗涤干燥后重1.74g,
(1)A的电子式是。
(2)由I可确定X中存在两种带负电荷的原子团及个数比
(3)由I判断X一定不含有的元素是。
(4)Ⅲ中生成B的离子方程式是。
(5)Ⅳ中B溶解的化学方程式是。
(6)沉淀C的化学式是。
(7)若X中n(B)∶n(C)=1∶3,则X的化学式是。
(I)多项选择题
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
E.利用化学反应原理,设计和制造新的药物
(II)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。
(1)海水淡化工厂通常采用的制备淡水的方法有(写出两种)。
(2)下图是从浓缩海水中提取溴 的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2 H2(g)+Si(g) 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为kg。
质量为kg。
(I)多项选择题
下列说法中正确的是。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是,其中Ti4+的氧配位数为,Ba2+的氧配位数为,
(3)常温下的TiCl4是有刺激性臭味的无 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有种同分异构体,请在下图方框中将其画出。