在一定条件下,可逆反应N2 +3H2 2NH3(正反应是放热反应);达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(正反应是放热反应);达到平衡,当单独改变下列条件后,有关叙述错误的是( )
| A.加催化剂V正、V逆都发生变化且变化的倍数相等 |
| B.加压V正、V逆都增大,且V正增大的倍数大于V逆增大的倍数 |
| C.降温V正、V逆都减小, 且V正的减小倍数大于V逆减小的倍数 |
| D.恒容加入氩气, V正、V逆均不变 |
如果你家里的食用花生油混有水份,你将采用下列何种方法分离
| A.过滤 | B.蒸馏 | C.分液 | D.萃取 |
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为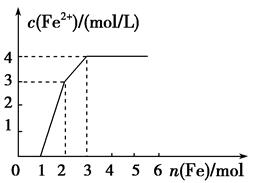
| A.1∶1∶1 | B.1∶3∶1 | C.3∶3∶8 | D.1∶1∶4 |
现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·L-1的硫酸溶液50 mL,恰好完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为
| A.1.6a g | B.(a-1.6) g | C.(a-3.2) g | D.1.6 g |
欲使0.1 mol·L-1 NaHCO3溶液中的c(H+)、c(CO32—)、c(HCO3—)都减少,其方法是
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.通入氯化氢气体 | D.加入饱和石灰水 |
1.92 g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
| A.504 mL | B.336 mL | C.224 mL | D.168 mL |