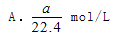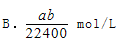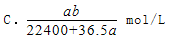钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是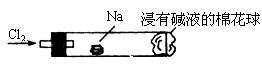
| A.反应生成的大量白烟是氯化钠固体 |
| B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 |
| C.钠着火燃烧产生苍白色火焰 |
| D.若在棉球外沿滴一滴淀粉碘化钾溶液,可根据其颜色变化判断氯气是否被碱液完全吸收 |
下列说法正确的是
A.化学反应不一定伴随着能量的变化
B.氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=571.6kJ·mol-1
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
下列反应中,熵减小的是
| A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) | B.2N2O5(g)=4NO2(g)+O2(g) |
| C.MgCO3(s)=MgO(s)+CO2(g) | D.2CO(g)=2C(s)+O2(g) |
下列反应既是氧化还原反应,又是吸热反应是
| A.实验室制备氢气 |
| B.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
| C.灼热的木炭与CO2的反应 |
| D.铝粉与氧化铁粉末反应 |
“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是
| A.推广“低碳经济”,减少温室气体的排放 |
| B.开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
| C.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 |
| D.开发利用可燃冰是缓解能源紧缺的唯一途径 |
将标准状况下的aLHCl气体溶于1000g水中,得到的盐酸密度为密度为b g/cm3,则该盐酸的物质的量浓度是