amol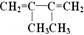 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧生成CO2、H2O、N2,在相同条件下,它们的体积比依次为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧生成CO2、H2O、N2,在相同条件下,它们的体积比依次为12:8:1,则a:b为( )
| A.1 :1 | B.3 :2 | C.2 :3 | D.1 :2 |
某实验过程如图所示,则图③试管中的现象是
| A.铜片溶解,产生无色气体,该气体遇空气变为红棕色 |
| B.铜片溶解,产生无色气体,该气体遇到空气不变色 |
| C.铜片溶解,放出红棕色有刺激性气味的气体 |
| D.无明显现象,因稀硫酸不与铜反应 |
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为
| A.10mol | B.11mol | C.12mol | D.13mol |
勤洗手和经常对环境进行消毒是预防传染病的有效途径。2012年4月,H7N9疫情爆发,可以用某种消毒液进行消毒,预防传染。已知该消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
| A.KMnO4 | B.H2O2 | C.NaClO | D.NH3·H2O |
下列溶液中能够区别SO2和CO2气体的是
①澄清石灰水②KMnO4酸性溶液③氯水④品红溶液
| A.①③④ | B.②③④ | C.①②③ | D.全部 |
(1)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质有许多相似之处。已知锡元素具有如下性质: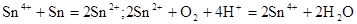 ;
;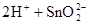

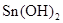

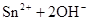 。
。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:_____________________________________________________,_______________________________________。
②将①中溶液蒸干后继续灼烧所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是__________(填化学式)。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱可选用________。
(2)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
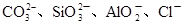 |
| 阳离子 |
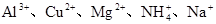 |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。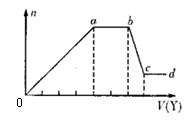
①若Y是盐酸,则溶液中含有的金属阳离子是_________,ab段发生反应的离子方程式为_______________,图中oa段参加反应的阴离子的物质的量之比为___________________。
②若Y是NaOH溶液,则bc段反应的离子方程式为____________________。
若不考虑离子的水解,忽略H+和OH-的影响,且溶液中只存在四种离子,则它们的离子个数比为_____________________________________________(按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列)。