下图所示水槽中试管内有一枚铁钉,放置数天后观察: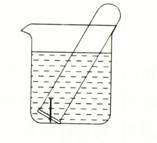
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的基态原子电子排布式为_______。
(2)b、c、d的第一电离能由大到小的顺序是_________(填元素符号)
(3)a和其他元素形成的二元共价化合物中,分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式)。
(4)d与c可以形成两种分子,低价态分子中心原子的杂化方式为_______该分子的空间构型为______________
(5)e和c形成的一种离子化合物的晶体结构如图,则该离子化合物的化学式为__________。(填元素符号)
(17分)二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
(2)已知在一定温度下,以下三个反应的平衡常数为k1、k2、k3:
(3)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解100mL 1mo1 的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
的食盐水(惰性电极),电解一段时间后,收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的负极反应式为_____________。
②电解后溶液的PH=_________________________
(4)工业合成氨的反应为: mol-1
mol-1
已知合成氨反应在某温度下2L的密闭绝热容器中进行,测得数据如下表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为_________
②该条件下反应的平衡常数k=________(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向_______(填“正向”、“逆向”或“不移动”),该反应的平衡常数k___________(填“变大”“减小”或“不变”)
(5)常温下,将0.2mol HCOOH和0.1mol
HCOOH和0.1mol NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
NaOH溶液等体积混合,所得溶液的PH<7,说明HCOOH的电离程度____________HCOONa的水解程度(填“大于”或“小于”)。该溶液中[HCOOH]-[OH-]+[H+]=______mol
(14分)已知有A、B、C、D、E五种短周期元素元素,其原子序数依次增大。F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体。A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正价与最低负价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,金属性最强的元素在周期表的位置是________写出D元素的原子结构示意图________
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈___性,原因________(离子方程式表示)上述化合物浓溶液滴加到Mg(OH)2悬浊液中,沉淀逐渐消失最后澄清,请解释澄清的原因______________________________________________
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为:____________________
检验该二价离子没有被完全氧化的方法为:_______________________________
(4).E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为____________________________________________________
(5分)化学实验是化学学科学习、探究的基础。
(1)下列描述错误的是_______.
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解。
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液肯定存在的离子是:_______________
在②中产生的自色沉淀是:_________________
(13分)实验室以含有少量铁的粗铜粉和硫酸与硝酸的混合溶液为原料制备CuSO4·5H2O(胆矾)晶体。设计的工艺流程图如下: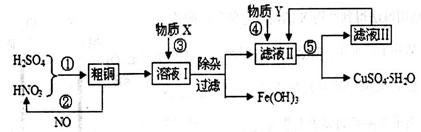
请回答下列问题:
(1)根据反应原理,操作①所需的混酸溶液中硝酸和硫酸的理论配比(物质的量之比)为________。操作②中需要把NO与_____气体混合通入水中,混入该气体的目的是__________________________(用化学方程式表示)。
(2)溶液I中存在一定浓度的Fe3+、Cu2+,在该浓度时生成氢氧化物沉淀的pH如下表。操作③中某学生设计物质X为H2O,若加水调整溶液pH,则Fe(OH)3开始沉淀的pH_______1.9(填“<”、“>”或“=”);而实际操作中一般不用此法调节溶液pH,其主要原因是___________________。
(3)操作④中物质Y为_______。查阅资料知CuSO4·5H2O的溶解度曲线如图所示,则操作⑤应采取的措施是蒸发浓缩、______________、过滤、洗涤、干燥等。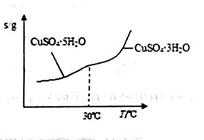
(4)为测定胆矾中结晶水的数目,称取25.0g胆矾品体在坩埚中加热,固体质量随温度升高而变化的曲线如图。
当固体质量为8.0g时,观察到固体完全呈黑色。请列式计算开始称取的胆矾中结晶水的数目。