关于下列各图的叙述,正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.乙表示恒温恒容条件下,2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸 ③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
| A.①② | B.② | C.②③ | D.④ |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
| 化学式 |
电离常数(298 K) |
| 硼酸 |
K=5.7×10-10 |
| 碳酸 |
K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 |
K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是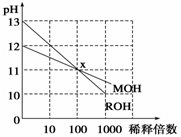
| A.ROH是一种强碱,MOH是一种弱碱 |
| B.在x点,c(M+)=c(R+) |
| C.稀释前,c(ROH)<10c(MOH) |
| D.稀释前,c(ROH)= 10c(MOH) |
某溶液中在25℃时由水电离出的氢离子浓度为1×10-12mol/L,下列说法正确的是
| A.HCO3-离子在该溶液中一定不能大量共存 |
| B.该溶液的pH一定是12 |
| C.向该溶液中加入铝片后,一定能生成氢气 |
| D.若该溶液的溶质只有一种,它一定是酸或碱 |
用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而增大的是
| A.c(H+)·c(NH3·H2O)/c(NH4+) | B.c(NH4+)·c(OH-)/c(NH3·H2O) |
C.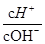 |
D.c(H+)·c(OH-) |