苯甲酸重结晶的实验操作步骤:加热溶解、 ▲ 、▲、过滤洗涤、烘干装瓶,在第一次过滤的过程前加入少量的水的目的: ▲
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: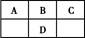
(1)设A、B、C、D四种元素的原子序数之和为m,则m 。
A.一定为奇数
B.一定为偶数
C.可能为奇数,也可能为偶数
(2)D元素原子的次外层电子数等于其他层电子数之和,则:
①写出A形成的简单离子的结构示意图 ,元素D位于元素周期表的第 族。
②A元素的一种氢化物分子中有6个原子,其结构简式为 。常压298 K时0.2 mol该气态氢化物在O2中完全燃烧,生成气态A单质和水,放出热量106.8 kJ,该气态氢化物燃烧的热化学方程式为 。
③写出C单质与B的最简单氢化物反应的化学方程式:
④实验证实AC3与水会发生反应生成HNO2和HF,则AC3和NaOH溶液反应的化学方程式为 。
为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为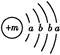 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+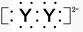
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2- 2Y-+Z↓
2Y-+Z↓
D.用电子式表示XY2的形成过程为: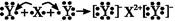
四种短周期非金属元素A、B、C、D原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是
(2)化合物CA3的电子式是 ,BD2分子的结构式为
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC Si;SiCl4 SiO2。
(2)如图立方体中心的“ ”表示硅晶体中的一个原子,请在立方体的顶点用“
”表示硅晶体中的一个原子,请在立方体的顶点用“ ”表示出与之紧邻的硅原子。
”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)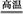 Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
Si(s)+4HCl(g),该反应的反应热ΔH= kJ/mol。
甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。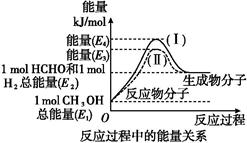
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? ,原因是
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式: 。