新型材料纳米α—Fe粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,α—Fe粉与蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
(1)甲同学用下图所示装置进行α—Fe粉与水蒸气的反应。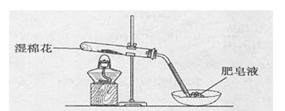
证明实验中有氢气产生的现象是 。
(2)乙同学用下图所示装置进行α—Fe粉与水蒸气的反应并验证产物。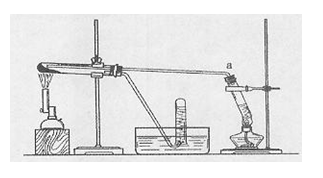
①试管a中的物质是 。
②乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 |
实验操作 |
实验现象 |
| Ⅰ |
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 |
黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ |
向实验I中得到的溶液滴加几滴KSCN溶液,振荡 |
|
实验现象不能确定是否存在Fe3O4,主要原因是 (用离子方程式表示)
③乙同学称取5.60gFe粉,用上图装置反应一段时候后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g。然后将冷却后的固体物质与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为 mol。
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由A、B组成,分子中原子个数比为A∶B=1∶1,常温时为气态。
(c)X由A、C组成,分子中原子个数比为A∶B=2∶1,常温时为液态。
(d)Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C∶D=1∶1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子个数比为1∶2。试完成下列各小题:
(1)各元素符号:A_____,B_____,C_____,D_____,E_____。
(2)W的化学式:__________。
(3)X的结构式:__________。
(4)Y的电子式:__________。
(5)Z的化学式:__________。
(6)写出下列反应化学方程式:Y与水反应__________。
A、B、C、D是四种短周期主族元素,其中B的原子序数最小,A、B同主族,C、D同主族,A比C的核外少两个电子;D元素一种原子的质量数是其质子数的两倍多2,又是该原子最外层电子数的3倍。判断A、B、C、D各是什么元素,并比较A、B、C三种元素的最高价氧化物对应的水化物溶液酸、碱性的相对强弱。
(1)A_____、B_____、C_____、D_____。(填元素符号)
(2) _____ (填酸性或碱性):_____>_____>_____。(填分子式)
A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。如果A和B同在ⅠA族,当B在A的上周期时,B的原子序数为_____;当B在A的下一周期时,B的原子序数为_____;如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为_____;当B在A的下一周期时,B的原子序数为_____。若A的氯化物化学式为ACly,分子中各原子最外层电子数之和为26,则y的值为_____。
在水溶液中, 和S2-发生反应的离子方程式如下:
和S2-发生反应的离子方程式如下: +3S2-+6H+
+3S2-+6H+  Y-+3S↓+3H2O
Y-+3S↓+3H2O
(1) 中Y元素的化合价是。
中Y元素的化合价是。
(2)Y元素原子的最外层电子数是。
(3)比较S2-和Y-的还原性。
用化学式回答原子序数11~18号元素的有关问题。
(1)除稀有气体外,原子半径最大的是。
(2)最高价氧化物对应的水化物中碱性最强的是。
(3)最高价氧化物对应的水化物中呈两性的是。
(4)最高价氧化物对应的水化物中酸性最强的是。
(5)形成的气态氢化物中最稳定的是。