下表是元素周期表的一部分,A、B、C、D、E、X、Y是一表中给出元素组成的常见单质或化合物。
I.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则A与水反应的化学方程式为 。
①当X是碱性盐溶液,C分子中有22个电子时,则C的电子式为 ,表示X呈碱性的离子方程式为 。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为 。
(2)若E为单质气体,D为白色沉淀,A的化学式可能是 , C与X反应的离子方程式为 。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式 。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为 。
在一定温度下,有A.盐酸 b.硫酸 C.醋酸三种酸:
(1)当其物质的量浓度相同时,C(H+)由大到小的顺序是___________________________;
(2)同体积、同物质的量浓度的三种酸,中和NAOH的能力由大到小的顺序是___________;
(3)若三者C(H+)相同时,物质的量浓度由大到小的顺序是_________________________;
(4)当三者C(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是_____________________________;
(5)当C(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________________,反应所需时间的长短关系是_________________________________;
(6)将C(H+)相同的三种酸均加水稀释至原来的100倍后,C(H+)由大到小的顺序是__
______________________________________________。
生活污水中含有大量的有机和无机含氮化合物,这些过量的含氮化合物会造成水体污染,危害水生生物生存和人类的健康。脱氮是污水处理的重要内容之一,其实质是在反应池中,pH为8.0—8.4时,硝化细菌大量繁殖,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应可用下式表示:
□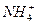 +□O2→□
+□O2→□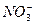 +□H++□H2O
+□H++□H2O
(1)配平上面的离子方程式,将化学计量数填入方框中。
(2)将铵态氮中的1 mg氮转化为硝酸根中的氮,需氧气多少毫克?
(3)为什么在反应中需要不断添加碱?
(4)在另一反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示:
□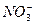 +5CH3OH→□N2↑+□CO2↑+□H2O+□OH-
+5CH3OH→□N2↑+□CO2↑+□H2O+□OH-
配平上面的离子方程式,将化学计量数填入方框中。
L、M、R、P、Q分别代表五种含不同化合价的氮元素的物质,A、B分别代表两种含不同氯元素的物质(每种物质中,氮和氯元素的化合价只有一种);又知M中氮元素的化合价要比Q物质中氮元素的化合价低。在一定条件下,它们会发生如下的转化(未配平):
①P+A→Q+B②L+O2→M+H2O③L+M→R+H2O④B+H2O→A+O2
(1)若五种含氮元素的物质中,有一种是硝酸,则硝酸是_______________________,理由是_____________________________________________________________________________。
(2)反应②必须在催化剂(铂、氧化铁等)作用下,加热到一定温度时方能发生,此反应在化工生产上有重要用途。据此推断在同温同压下,若物质R的密度比二氧化碳的密度小,则R的化学式为___________________________________________________________________。
(3)某学生写出下面三个含氮物质的相互转化的关系式:
(a)M+P→N2O3+H2O (b)N2O4+H2O→P+Q (c)M+L→Q+H2O
其中一定不可能实现的是____________,理由是____________________________________
______________________________________________________________________________。
某学生两次分别用2.6 g锌与硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g的HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的反应方程式___________________________
_______________________________________________________________________________。
配平下列化学方程式:
(1)K2Cr2O7+HCl(浓)——KCl+CrCl3+Cl2↑+H2O
(2)Fe3C+HNO3(浓)——Fe(NO3)3+CO2↑+NO2↑+H2O
(3)Fe(OH)3+NaOH+Cl2——Na2FeO4+NaCl+H2O
(4)S+Ca(OH)2——CaSx+CaS2O3+H2O
(5) +H2S+H+——Mn2++S↓+H2O
+H2S+H+——Mn2++S↓+H2O