向10.00 mL 0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如右图所示。下列说法不正确的是( )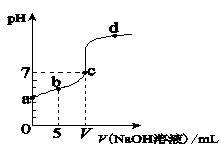
A.HA是弱酸
B.b点表示的溶液中:2c(Na+) = c(A-) + c(HA)
C.c点时:V=" 10.00" mL
D.b、c、d点表示的溶液中:c(Na+) + c(H+) = c(A-) + c(OH-)
下列关于盐酸与醋酸两种稀溶液的说法正确的是 ()
| A.相同浓度的两溶液中c(H+)相同 |
| B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液都稀释10倍,盐酸的pH大于醋酸的PH |
| D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小 |
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是()
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
可逆反应N2O4 2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是①减小压强 ②缩小体积③升高温度④增大N2O4的浓度()
2NO2△H>0在密闭容器中反应,达到平衡状态,要使混合气体颜色加深,可采取的方法是①减小压强 ②缩小体积③升高温度④增大N2O4的浓度()
| A.②③④ | B.①②③ | C.①③④ | D.①②③④ |
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸②浓硫酸③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
可逆反应mA(固)+nB(气)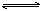 eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )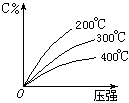
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |