(选修—有机化学基础)苯酚是重要的化工原料,通过下列流程可合成阿司匹林、冬青油和一些高分子化合物。已知:
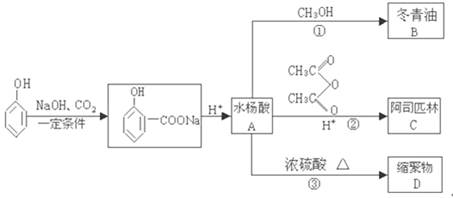
试按要求回答:
(1)由水杨酸A合成阿司匹林C的反应类型是 。
(2)写出C、D的结构简式:C ,D 。
(3)写由水杨酸A合成冬青油B的化学方程式: 。
(4)水杨酸A易溶于冬青油中使产品不纯,用NaHCO3溶液反应后,经过 操作得到较纯净的冬青油,写出A与NaHCO3溶液反应的化学方程式: 。
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(写出一种试剂即可) 。
(8分)已知甲元素是第三周期p区元素,其最低氧化值为-1,乙元素是第四周期d区元素,其最高氧化值为+4,试填下表:
| 元素 |
价电子构型 |
族 |
金属或非金属 |
电负性相对高低 |
| 甲 |
||||
| 乙 |
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g) Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。
Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值,平衡常数K值(均选填“增大”“减小”或“不变”)。
(2)1 100 ℃时测得高炉中[CO2]="0.025" mol·L-1,[CO]="0.1" mol·L-1,在这种情况下,该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率v(正)v(逆)(填“大于”“小于”或“等于”),其原因是。
实验表明,液态时,纯硫酸的电离能力强于硝酸,纯硫酸的导电性也显著强于纯水。又知液态纯酸都像水那样进行自身电离(H2O+H2O H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
H3O++OH-)而建立平衡,且在一定温度下都有各自的离子积常数。据此回答:
(1)纯硫酸在液态时自身电离的方程式是。
(2)25 ℃时,液态纯硫酸的离子积常数K(H2SO4)1×10-14(填“>”“<”或“=”)。
(3)在纯硫酸与纯硝酸的液态混合酸中,存在的阴离子主要是,这是因为混合酸中不仅存在硫酸和硝酸各自电离的两个电离平衡,而且还因硫酸的酸性大于硝酸,又在无水条件下,混合酸中必然发生(写离子方程式)反应而造成的。
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3、AgNO3中的一种。
①A与B反应有气体生成
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体生成
⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是____________________。
(2)A是___________,B是___________,C是___________,D是___________,E是___________。
(3)A与E反应的离子方程式是________________________________________________。
某工厂甲、乙两车间,分别排放的污水中含有大量的Ag+、Ba2+、Fe3+、Na+、Cl-、 、
、 、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
、OH-中的四种。若各自单独排放会造成较大污染,如果混合后再排放,则会大大降低污染程度。现测得甲车间排放的污水呈碱性。则
(1)甲车间污水中含有的四种离子可能是___________________________。
(2)乙车间污水中含有的四种离子可能是___________________________。