金属铝在酸性或碱性溶液中均可与NO3-发生氧化还原反应,转化关系如下图所示:
其中,气体D和F反应可生成盐,气体D和A溶液反应生成白色沉淀。
请回答下列问题:
(1)当Al与稀硝酸反应时,稀硝酸表现的性质是
A.只表现强氧化性
B.只表现酸性
C.同时表现强氧化性及酸性
D.表现了强氧化性还表现了还原性
(2)在下列离子方程式的横线上填写产物的化学式(不需要配平)
Al + NO3-+ OH-+ H2O—→ +
(3)过量D的水溶液与A溶液反应的离子方程式是
(4)D—→C反应的化学方程式是
(5)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质是
(6)除去C中的E气体杂质可用的化学方法是:(用化学方程式表示)
(7)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是 。
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)这三种氧化物中,属于酸性氧化物的是____________(用化学式表示)。
(2)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+8NH  7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1= - 196.6 kJ·mol-1
2SO3(g) ΔH1= - 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2= - 113.0 kJ·mol-1
2NO2(g) ΔH2= - 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 ΔH3=kJ·mol-1。
SO3(g)+NO(g)的 ΔH3=kJ·mol-1。
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+ Cl2↑+2H2O
(1)氧化剂是________, 氧化产物是________。
(2)浓盐酸在反应中显示出来的性质是________(填编号)
①只有还原性②还原性和酸性 ③只有氧化性④氧化性和酸性
(3)产生0.1mol Cl2,则转移电子的物质的量为________mol。
(4)将分离出来的氯气常温下通入NaOH,可以得到漂白液,反应的离子方程式为___________________________________________________。
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 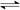 2NH3(g)△H = -92 kJ·mol-1
2NH3(g)△H = -92 kJ·mol-1
T1℃时,在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示: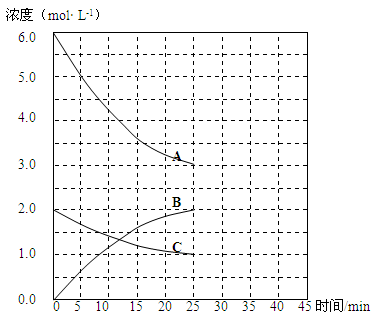
请回答:
(1)若反应起始时n(N2)为1mol、n(H2)为3mol,则反应达到平衡时,放出的热量(填“=”或“<”或“>”)92 kJ
(2)表示N2浓度变化的曲线是(填浓度变化曲线代号“A”或“B”或“C”)。
(3)用H2浓度的变化表示该反应在0~25min末的速率是mol·L-1·min-1。
(4)若该反应在一定条件下于25 min末达到平衡状态,则
①此时平衡常数K = 。
②保持该反应条件不变至第30 min末,将温度由T1℃升高到T2℃,则反应在第40min末再次达到平衡,在此过程中H2浓度变化了1.5 mol·L-1,请在图中画出从第25 min末 ~ 45min末NH3浓度的变化曲线。
Al及其化合物用途广泛,工业上可以将明矾石经处理后得到明矾[KAl(SO4)2·12H2O],再将明矾焙烧后制得Al2O3等物质,进一步处理后还可以得到Al。
已知焙烧明矾的化学方程式为:
请回答:
(1)Al2O3的摩尔质量是。
(2)工业上可用电解Al2O3制备Al,其化学方程式是。
(3)在焙烧明矾的反应中,氧化剂和还原剂的物质的量之比是。
(4)焙烧明矾时产生的SO2可综合利用来制硫酸。
已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1 = 一197 kJ/mol
2SO3(g)△H1 = 一197 kJ/mol
2H2O (g)=2H2O(1)△H2 = 一44 kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3 = 一545 kJ/mol
SO3(g)与H2O(l)反应的热化学方程式是。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式。
②电池总反应的化学方程式。
工业上可用电解法来处理含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而被除去。下图为电解装置示意图(电极材料分别为铁和石墨):
请回答:
(1)装置中的b电极是(填“阳极”或“阴极”)。
(2)a电极的电极反应式是。
(3)完成b电极附近溶液中反应的离子方程式:
Cr2O72-+6Fe2++14H+=2+6+7
(4)电解时用铁不用石墨做阳极的原因是。
(5)电解结束后,若要检验电解液中还有Fe2+存在,可选用的试剂是(填字母)。
| A.KSCN溶液 | B.CuCl2溶液 | C.H2O2溶液 | D.K3[Fe(CN)6] |