已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1 = -Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= -Q2 KJ/mol
2H2(g)+O2(g)==2H2O(l) △H3 = -Q 3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是
| A.放出的热量为(0.4 Q 1+0.05 Q 3)KJ/mol | B.放出的热量为(0.4 Q 1+0.05 Q 2)KJ/mol |
| C.△H2 = △H3 | D.△H2 <△H3 |
化学与生产、生活密切相关。下列叙述中,正确的是( )
| A.制作计算机芯片的材料是SiO2晶体,84消毒液的有效成分是NaClO |
| B.水在4℃时主要以(H2O)2存在,两个水分子间可能以某种特殊的分子间作用力相结合 |
| C.0.2摩尔铝和足量氢氧化钠溶液反应,参加还原反应的水是3.6克 |
| D.SO2和CO2都能使雨水的pH < 5.6,造成酸雨 |
水的电离平衡曲线如图所示,下列说法不正确的是()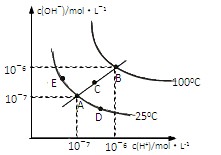
| A.图中五点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用:温度不变在水中加入少量的酸 |
| C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |
| D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl 固体的变化 |
下列装置图或曲线图与对应的叙述相符的是()
| A.图1:固体KNO3中混有NaCl,可用重结晶进行提纯 |
| B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g)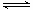 2SO3(g) ΔH<0”的平衡常数K正、K逆随温度 2SO3(g) ΔH<0”的平衡常数K正、K逆随温度 |
用S-诱抗素制剂,可以保证鲜花盛开。S-诱抗素的结构如图,下列关于该物质的说法正确的是 ()
| A.其分子中含有两个手性碳原子 |
| B.既能发生加聚反应,又能发生缩聚反应 |
| C.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
下列有关分类的观点正确的是()
①由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应;
②铅蓄电池、锂电池、碱性锌锰电池都属于二次电池;
③碳素钢、不锈钢和目前流通的硬币都属于合金;
④生物质能、沼气和乙醇都是可再生能源;
⑤氨水、醋酸、氢氧化铝都属于弱电解质。
| A.①② | B.②④ | C.③④ | D.③⑤ |