下列各组中化合物的性质比较,不正确的是( )
| A.酸性:HClO4>HBrO4>HIO4 | B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.稳定性:PH3 > H2S> HCl | D.还原性: F-< Cl-< I- |
在25℃时,甲、乙两个烧杯中分别盛有1 L、pH均为2的盐酸和醋酸,现分别投入0.12 g镁粉充分反应,下列说法中,正确的是
| A.反应过程中,两个烧杯中产生氢气的速率一直相等 |
| B.反应结束后,两个烧杯中产生氢气的物质的量相等 |
| C.反应结束后,乙烧杯中有镁粉剩余 |
| D.反应结束后,甲烧杯中溶液呈中性 |
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体N2O4的混合气体1120mL(标准状况)。向反应后的溶液中加入1.0 mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:l |
| B.该浓硝酸中HN03的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
下列操作不能达到实验目的的是
| 目的 |
操作 |
|
| A |
在溶液中将MnO4-完全转化为Mn2+ |
向酸性KMnO4溶液中滴加溶液至紫色消失 |
| B |
除去KNO3中少量NaCl |
将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C |
配制980mL0.1mol/LCuSO4溶液 |
将25.0gCuSO4·5H2O溶于水配制成1L溶液 |
| D |
确定蔗糖是否水解 |
取水解液滴加少量新制的Cu(OH)2悬浊液,加热 |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化铁制备金属钛。下列说法中正确的是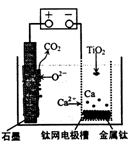
| A.将熔融CaF2-CaO换成Ca(NO3)2溶液也可以达到相同目的 |
B.阳极的电极反应式为:C+2O2--4e- CO2↑ CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+"接线柱应连接Pb电极 |
下列有关铁及其化合物的离子方程式一定错误的是
A.氢氧化铁与氢碘酸反应:Fe(OH)3+3H+ Fe3++3H2O Fe3++3H2O |
B.铁与稀硝酸反应:Fe +4H+ + NO3- Fe3+ + NO↑+ 2H2O Fe3+ + NO↑+ 2H2O |
C.磁性氧化铁与浓盐酸反应:Fe3O4+8H+ 2Fe3++Fe2++4H2O 2Fe3++Fe2++4H2O |
D.溴化亚铁溶液与氯水反应:2Fe2++4Br-+3Cl2 2Fe3++2Br2+6Cl- 2Fe3++2Br2+6Cl- |