元素在同期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
下列分离或提纯有机物的方法正确的是
| 选项 |
待提纯物质 |
杂质 |
除杂试剂及主要操作方法 |
| A |
苯 |
溴单质 |
加亚硫酸钠溶液洗涤,分液 |
| B |
淀粉 |
葡萄糖 |
水,过滤 |
| C |
甲烷 |
乙烯 |
通入酸性高锰酸钾溶液,洗气 |
| D |
乙酸乙酯 |
乙酸 |
加入氢氧化钠溶液,分液 |
将0.1 mol/L下列物质的水溶液从常温加热到90℃,在此过程中溶液的PH不变的是
| A.氯化钠 | B.氢氧化钾 | C.硫酸 | D.硫酸铵 |
实验小组中甲同学按图完成实验,发现电流计指针偏转,乙同学将图中盐桥(琼脂和饱和氯化钾)换成U形铜丝代替盐桥,发现电流计指针也发生偏转,以下说法正确的是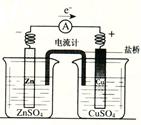
| A.甲同学实验过程中,ZnSO4溶液中阴离子总浓度不会发生改变 |
| B.甲同学实验过程中,Zn片被氧化,铜片被还原 |
| C.乙同学将盐桥换成铜丝后,导线中电流方向不会发生变化 |
| D.乙同学将盐桥换成铜丝后,U形铜丝的两端电极反应类型一致 |
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1 mol/L H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| B |
向SO2水溶液中滴入几滴BaCl 2溶液,振荡 |
滴加BaCl2后出现白色沉淀 |
此沉淀一定是BaSO3 |
| C |
等体积PH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 |
HA放出的氢气多且反应速率快 |
HB酸性比HA强 |
| D |
先向2mL 0.1mol/L Na2S溶液中滴入几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液 |
开始有白色沉淀生成;后又有黑色沉淀生成 |
溶度积(Ksp):ZnS>CuS |
短周期元素X、Y、Z、W、Q的原子序数依次增大,各元素原子的最外层电子数之和比Ca2+的核外电子数少1个,X与Q处于同一主族,Y、Z、W处于同一周期的相邻位置。下列叙述不正确的是
| A.X与Z组成的化合物之一可作为火箭发射的高能燃料 |
| B.Y与W形成的阴离子可能有YW32- 或Y2W42- |
| C.化合物Q2W2与X2W反应时,Q2W2只做氧化剂 |
| D.CaX2、CaY2分别与水反应可产生两种可燃性气体 |