下列说法正确的是
A.NaCl固体中含有共价键 B.CO2分子中含有离子键
C.12 6C、13 6C、14 6C是碳的三种核素 D.16 8O、17 8O、18 8O含有相同的中子数
含有硒(Se)的保键品已进入市场,已知该元素与氧具有相同的最外层电子数。则下列关于硒的叙述中不正确的是
| A.最高价氧化物的化学式为SeO3 |
| B.单质Se是一种半导体材料 |
| C.原子半径比硫大,比溴小 |
| D.单质的氧化性比氯气弱,比溴强,比O3弱 |
在100mL含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2。原溶液中HBr和H2SO3的浓度都等于()
| A.0.0075mol/L | B.0.0018mol/L | C.0.075mol/L | D.0.08mol/L |
标准状况下的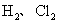 混合气体a L,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变为盐,则a、b的关系不可能为( )
混合气体a L,经光照充分反应后,所得气体恰好使溶液中b mol NaOH完全转变为盐,则a、b的关系不可能为( )
A.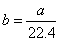 |
B. |
C.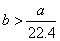 |
D.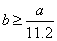 |
氯化碘(ICl)的化学性质与卤素相似,预计它跟水反应的最初生成物是( )
| A.HI和HClO | B.HCl和HIO |
| C.HClO3和HIO | D.HClO和HIO |
下列物质中,能使紫色石蕊试液因漂白而褪色的是( )
A.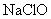 |
B.活性炭 | C.氯水 | D.盐酸 |