下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物具有两性
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为L<Q
当两个氢原子核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低。下图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有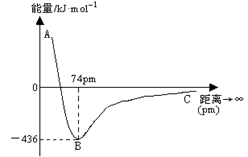
| A.氢分子比氢原子稳定 |
| B.氢原子的半径约为37pm |
| C.形成一个H—H键吸收436kJ能量 |
| D.当核间距接近74pm时,形成了氢分子中s~s σ键 |
某元素原子的价电子构型为2s22p5,下列有关该元素的描述正确的有
| A.原子序数为7 | B.电负性最大 | C.原子半径最大 | D.第一电离能最大 |
科学家最近研制出可望成为高效火箭推进剂的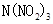 (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关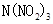 的说法正确的是
的说法正确的是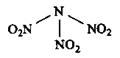
| A.分子中N、O间形成的共价键是非极性键 |
| B.分子中四个氮原子共平面 |
| C.该物质属于离子化合物 |
D.15.2g该物质含有6.02×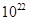 个分子 个分子 |
关于SO2分子与CO2分子说法正确的是
| A.均为非极性分子 | B.中心原子都采取sp杂化轨道 |
| C.S原子和C原子上都没有孤对电子 | D.SO2为V形结构,CO2为直线形结构 |
下列化合物中不含配位键的是
| A.[Cu(H2O)4]SO4·H2O | B.Na2CO3·10H2O | C.CuSO4·5H2O | D.Na[Al(OH)4] |