. 168O、188O、O2-、O2、O3是:
| A.氧元素的五种不同微粒 | B.五种氧元素 |
| C.氧的五种同素异形体 | D.氧的五种同位素 |
甲、乙、丙、丁四种物质分别含两种或三种元素,它们的每个分子中均含18个电子。甲是气态氢化物,在水中可分步电离出两种阴离子。下列推断合理的是
| A.某钠盐溶液中含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物 |
| D.丁中两元素质量比与甲中两元素质量比相同,则丁中一定含有-1价的元素 |
某溶液中加入金属铝,产生大量H2,该溶液中一定不能大量共存的离子组是
A.K+、Na+、SO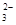 、S2- 、S2- |
B.Ba2+、Fe2+、NO 、Br- 、Br- |
C.K+、Na+、AlO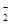 、SO 、SO |
D.NH 、Cu2+、Cl-、Br- 、Cu2+、Cl-、Br- |
根据化学原理得出有关判断,其中正确的是
| A.由于水分子间存在氢键,所以稳定性:H2O>H2S |
| B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 |
| C.若弱酸HA的酸性强于弱酸HB,则同温度、同浓度钠盐溶液的碱性:NaA<NaB |
| D.一定条件下,氯酸钾与碘发生反应2KClO3+ I2=2KIO3+Cl2,则氧化性:I2>Cl2 |
一定温度下可逆反应:A(s)+2B(g) C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将2 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将2 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1 mol A和2 mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2 mol D,达到新平衡后,c(B)乙≤2c(B)甲
下列说法中,正确的是
| A.BF3分子中没有原子的最外层满足8电子稳定结构 |
| B.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| C.全氟丙烷(C3F8)分子中三个碳原子可能处于同一直线上 |
D.向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况),其离子反应方程式可表示为:3OH-+2CO2=CO +HCO +HCO +H2O +H2O |